
 的一氯代物共有( )
的一氯代物共有( )| A、3种 | B、4种 | C、5种 | D、6种 |
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| 操作和现象 | 结论 | |
| A | 向装有Fe(NO3)2溶液的试管中加入稀H2SO4,在管口观察到红棕色气体 | HNO3分解生成了NO2 |
| B | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2浊液,加热,没有红色沉淀生成 | 淀粉没有水解成葡萄糖 |
| C | 向饱和Na2CO3溶液中通入足量CO2,溶液变浑浊 | 析出了NaHCO3 |
| D | 向无水乙醇中加入浓H2SO4,加热至170℃产生的气体通入酸性KMnO4溶液,红色褪去 | 使溶液褪色的气体是乙烯 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、滴入酚酞溶液显红色的溶液中:K+、Na+、Cu2+、SO42- |
| B、加入过量NaOH溶液或少量稀H2SO4时,都能产生白色沉淀的溶液:Al3+、Ba2+、Cl-、HCO3- |
| C、水电离产生的c(H+)=10-13mol?L-1的溶液中:Na+、Cl-、NO3-、SO42- |
| D、0.1mol?L-1HNO3溶液中:Mg2+、NH4+、Fe2+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(HCO3-)=1×10-1mol/L的溶液中Na+、AlO2-、CH3COO-、K+ |
| B、由水电离出的c(H+)=1×10-14mol/L的溶液中CO32-、NH4+、SO42-、K+ |
| C、甲基橙呈红色的溶液中Fe2+、Cl-、NO3-、Na+ |
| D、能使pH试纸呈红色的溶液中Mg2+、Cl-、NO3-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2013年0点钟声敲响后的几个小时,北京的污染指数从轻度污染上升为重度污染,主要污染为PM2.5污染,看来烟花爆竹的燃放,可加重PM2.5污染 |
| B、催化剂之所以能加快反应速率,是因为催化剂能降低反应的活化能 |
| C、氨气的水溶液氨水可以导电,因此氨气是电解质 |
| D、大量燃烧含硫燃料是形成酸雨的主要原因 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下,16g O2和O3的混合气体中含有1.5NA个氧原子 |
| B、常温下,1L 1mol?L-1 Na2CO3溶液中所含的CO32-为NA |
| C、58g乙烯和乙烷的混合气体中碳原子数目一定为4NA |
| D、常温常压下,足量的Fe在1mol Cl2中充分燃烧,转移的电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
 B.现有A、B、C、D、E、F五种有机物,它们的转化关系如下图所示(图中部分反应条件及生成物没有全部写出).已知:液体B能发生银镜反应,气体D的相对分子质量为28.
B.现有A、B、C、D、E、F五种有机物,它们的转化关系如下图所示(图中部分反应条件及生成物没有全部写出).已知:液体B能发生银镜反应,气体D的相对分子质量为28.查看答案和解析>>
科目:高中化学 来源: 题型:
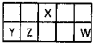 I.短周期元素X、Y、Z、W在元素周期表中相对位置如图所示,其中Y所处的周期序数与族序数相等.按要求回答下列问题:
I.短周期元素X、Y、Z、W在元素周期表中相对位置如图所示,其中Y所处的周期序数与族序数相等.按要求回答下列问题:| 温度/℃ | 400 | 500 | 600 |
| 平衡常数K | 9.94 | 9 | 1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com