
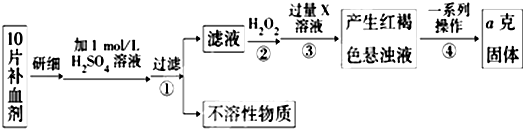
| 56×2 |
| 160 |


科目:高中化学 来源: 题型:
| A、将2mol金属Cu与含2molH2SO4的浓硫酸共热 |
| B、将1 mol MnO2固体与含4molHCl的浓盐酸共热 |
| C、常温下,将32.2g金属钠和5.4g金属铝同时投入到足量水中 |
| D、常温下,将10.8g的Al和22.4g的Fe投入到300g 98%的硫酸中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、单质硅常用做半导体材料和光导纤维,SiO2是人类将光能转化为电能的常用材料 |
| B、纯碱、烧碱、Al(OH)3等常用于治疗胃酸过多 |
| C、H2O2、Na2O2、氯水、漂白粉、84消毒液均可作漂白剂和消毒剂,且它们的漂白原理相同 |
| D、镁铝合金常用于制作窗框是因为它具有坚硬、密度小、溶点高、耐腐蚀等优良性能 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

 )
)查看答案和解析>>
科目:高中化学 来源: 题型:

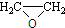 ).写出以邻甲基苯酚(
).写出以邻甲基苯酚(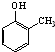 )和乙醇为原料制备
)和乙醇为原料制备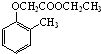 的合成路线流程图(无机试剂任用).
的合成路线流程图(无机试剂任用).查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

| 环境温度/°C | 5 | 10 | 15 | 20 | 25 | 30 | 35 |
| 显色时间/min | 45 | 30 | 15 | 13 | 10 | 7 | 5 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2CO3溶液(Na2SO4),加入适量的Ba(OH)2溶液,过滤 |
| B、NaHCO3溶液(Na2CO3),应通入过量的CO2气体 |
| C、Na2O2粉末(Na2O),将混合物在氧气中加热 |
| D、Na2CO3溶液(NaHCO3),选用适量的NaOH溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com