
【题目】亚硝酸钠是重要的防腐剂,某化学兴趣小组以铜和稀硝酸为起始原料,设计如下装置利用NO与Na2O2反应制备NaNO2。(夹持装置已略)
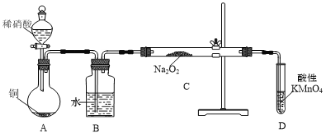
(1)A中反应的化学方程式为_____。
(2)B装置的作用是_____,装置D的作用是_____。
(3)为防止生成其他杂质,B、C装置间还应接入装有_____(填试剂名称)的_____(填仪器名称)。
(4)测定C装置中NaNO2的质量分数的过程如下:准确称取装置C中反应后的固体0.600 g于锥形瓶中,先加水溶解,再向其中滴加0.1000 mol·L-1酸性KMnO4溶液,恰好完全反应时,消耗酸性KMnO4溶液24.00 mL。计算装置C中所得固体中NaNO2的质量分数___________(请写出计算过程)。已知测定过程中发生反应的方程式为MnO4-+NO2-+H+—Mn2++NO3-+H2O(未配平)
【答案】3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O 除去NO中可能混有的NO2 除去未反应掉的NO,防止污染空气 浓硫酸(碱石灰) 洗气瓶(干燥管) n(KMnO4)=24.00 mL×0.1000 mol·L-1×10-3 L·mL-1=2.4×10-3 mol,根据得失电子守恒或关系式n(KMnO4) ×5=n(NO2-)×2 ,n(NO2-)=0.006 mol,NaNO2的质量分数为0.006×69÷0. 600×100%=69.00%
【解析】
⑴A中反应的反应主要是稀硝酸与铜反应,其化学方程式为3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,故答案为3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;
⑵A中主要产生NO气体,由于里面含有空气,会生成二氧化氮,因此B主要是将A中的二氧化氮变为NO,所以B装置的作用是除去NO中可能混有的NO2,装置C中NO和过氧化钠反应,但NO未反应完,会污染空气,因此D主要是除掉未反应完的NO,所以D的作用是除去未反应掉的NO,防止污染空气,故答案为除去NO中可能混有的NO2;除去未反应掉的NO,防止污染空气;
⑶由于在通入水的过程中有水蒸气带出,水会与过氧化钠反应,为防止生成其他杂质,B、C装置间还应接入装有省油浓硫酸的洗气瓶或者是装有碱石灰的干燥管,故答案为浓硫酸(碱石灰);洗气瓶(干燥管);
⑷消耗酸性KMnO4溶液24.00 mL,0.1000 mol·L-1,因此物质的量为![]()
配平方程式得到:
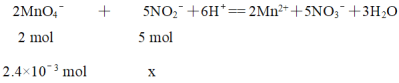
![]()
x = 6×10-3 mol
因此NaNO2的质量分数为![]() ,
,
故答案
消耗酸性KMnO4溶液24.00 mL,0.1000 mol·L-1,因此物质的量为![]()
配平方程式得到:
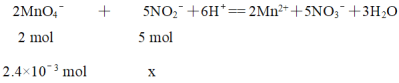
![]()
x = 6×10-3 mol
因此NaNO2的质量分数为![]() 。
。


科目:高中化学 来源: 题型:
【题目】二氯化二硫(S2Cl2)在工业上用于橡胶的硫化,还可以作为贵金属的萃取剂。可由硫和氯气在100~110 ℃直接化合而成。实验室用以下装置制备S2Cl2并对尾气进行回收利用。已知S2Cl2的熔点:-77 ℃,沸点:137 ℃,S2Cl2遇水剧烈反应。
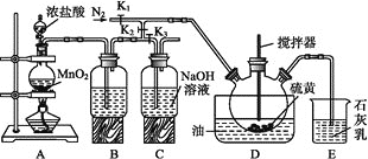
(1)S2Cl2遇水会生成黄色单质、一种能使品红溶液褪色的气体化合物及酸雾,写出该反应的化学方程式__________________________________。
(2)B中所装试剂名称为__________________________。
(3)A、B装置中的空气可以通过控制K2、K3来去除,具体方法为_________。
(4)装置E的作用是____________________________________________,写出E中发生的氧化还原反应的化学方程式_________________________。
(5)实验时,D装置开始需要油浴加热一段时间,之后停止加热,仅需通入氯气即可。生成二氯化二硫的反应为________ (填“放热”或“吸热”)反应。
(6)该装置由于存在系统缺陷,使制得的二氯化二硫可能不纯,现需对该装置进行改进,则改进的方法为____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1 mol CH4和适量O2在密闭容器中混合点燃,充分反应后CH4和O2均无剩余,且产物均为气体,质量为72 g。下列叙述正确的是
A. 若将产物通过碱石灰,则可全部被吸收;若通入浓硫酸,则不能完全被吸收
B. 产物的平均摩尔质量为20 g·mol-1
C. 若将产物通过浓硫酸后恢复至室温,压强变为原来的1/2
D. 反应中消耗O256 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】《 Journal of Energy Chemistry》报导我国科学家设计CO2熔盐捕获与转化装置如图。下列有关说法正确的是

A. a为负极
B. 熔盐可用KOH溶液代替
C. d极电极反应式为CO32-+4e-===C+3O2-
D. 转移lmol电子可捕获CO211.2L(标况下)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室回收废水中的苯酚的过程如图所示。下列说法正确的是

A.操作I为蒸馏B.反应Ⅰ也可加入Na2CO3
C.操作Ⅱ所得有机层可循环利用D.操作Ⅲ所得水层为Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳是潜在的碳资源,无论是天然的二氧化碳气藏,还是各种炉气、尾气、副产气,进行分离回收和提浓,合理利用,意义重大。
(1)在空间站中常利用CO2(g)+2H2(g)![]() C(s)+2H2O(g),再电解水实现O2的循环利用,350℃时,向体积为2L的恒容密闭容器中通入8molH2和4molCO2发生以上反应。
C(s)+2H2O(g),再电解水实现O2的循环利用,350℃时,向体积为2L的恒容密闭容器中通入8molH2和4molCO2发生以上反应。
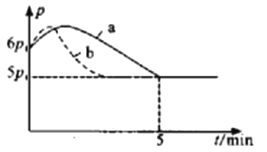
①若反应起始和平衡时温度相同(均为350℃),测得反应过程中压强(p)随时间(t)的变化如图中a所示,则上述反应的△H___________0(填“>”或“<”);其他条件相同时,若仅改变某一条件,测得其压强(p)随时间(t)的变化如图中曲线b所示,则改变的条件是___________。
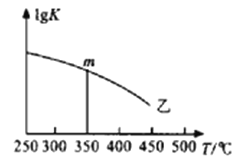
②图是反应平衡常数的对数与温度的变化关系图,m的值为___________。
(2)CO2在 Cu-ZnO催化下,同时发生如下反应I,II,是解决温室效应和能源短缺的重要手段。
Ⅰ.CO2(g)+3H2(g)![]() CH3OH (g)+H2O(g) △H1<0
CH3OH (g)+H2O(g) △H1<0
Ⅱ.CO2(g)+H2(g)![]() CO(g)+ H2O(g) △H2>0
CO(g)+ H2O(g) △H2>0
保持温度T时,在容积不变的密闭容器中,充入一定量的CO2及H2,起始及达平衡时,容器内各气体物质的量及总压强如下表:
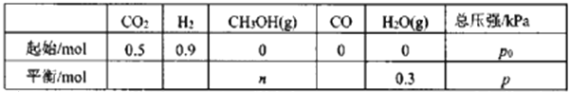
若反应I、II均达平衡时,p0=1.4p,则表中n=__________;反应1的平衡常数Kp=____ (kPa)-2。(用含p的式子表示)
(3)Al-CO2电池是一种以低温熔融盐[Al2(CO3)3]为电解质,以完全非碳的钯Pd包覆纳米多孔金属为催化剂正极的可充电电池。正极反应为:3CO2+4e-=2CO32-+C,则生成Al的反应发生在___________极(填“阳”或“阴”),该电池充电时反应的化学方程式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。完成下列填空:
(1)已知碘元素最终变为无色HIO3。上述整个过程中的还原剂是_______________________。写出CCl4层变成紫色的离子反应方程式________________________________________。
(2)若把KI换成KBr,则CCl4层变为_________色,继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是______________________________________。
(3)智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘。试配平该反应的化学方程式,并用短线标出电子转移方向及总数__NaIO3+NaHSO3→NaHSO4+Na2SO4+I2+_H2O,已知含氧酸盐的氧化作用随溶液酸性的加强而增强,在制备试验时,定时取样,并用酸化的氯化钡来检测SO42-离子生成的量,发现开始阶段反应速度呈递增的趋势,试简述这变化趋势发生的原因:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D 4种可溶性盐,它们的阳离子可能分别是Ca2+、Ag+、Na+、Cu2+中的某一种,阴离子可能分别是NO3-、SO42-、Cl-、CO32-中的某一种。
①若把4种盐分别溶解于盛有蒸馏水的4支试管中,均得澄清溶液,只有B盐的溶液呈蓝色。
②若向①的4支试管中分别加盐酸,C溶液中有沉淀产生,A溶液中有无色无味气体逸出。
(1)根据①②的事实推断B、C的化学式分别为_________、___________
(2)写出A与D反应的化学方程式:______________________________________;
(3)若想从A与D反应后的混合物中分别提取两种固体产物,需要进行的实验操作是_________和________.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com