
实验测得某反应在不同pH下产物A的浓度随时间变化的关系如图(其他条件相同)。则下列有关说法正确的是( )
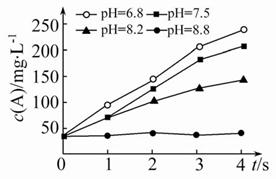
A.若增大压强,该反应的反应速率一定增大
B.pH=6.8时,随着反应的进行反应速率逐渐增大
C.一定pH范围内,溶液中H+浓度越小,反应速率越快
D.可采用调节pH的方法使反应停止
 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
灰锡(以粉末状存在)和白锡是锡的两种同素异形体.已知:
①Sn(s,白)+2HCl(aq)═SnCl2(aq)+H2(g)△H1
②Sn(s,灰)+2HCl(aq)═SnCl2(aq)+H2(g)△H2
③Sn(s,灰)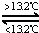 Sn(s,白)△H3=+2.1kJ•mol﹣1,
Sn(s,白)△H3=+2.1kJ•mol﹣1,
下列说法正确的是( )
|
| A. | △H1>△H2 |
|
| B. | 锡在常温下以灰锡状态存在 |
|
| C. | 灰锡转为白锡的反应是放热反应 |
|
| D. | 锡制器皿长期处在低于13.2℃的环境中,会自行毁坏 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知常温下,浓度均为0.1mol•L﹣1的4种钠盐溶液pH如下表:下列说法中正确的是( )
| 溶质 | Na2CO3 | NaClO | NaHCO3 | NaHSO3 |
| pH | 11.6 | 10.3 | 8.3 | 5.2 |
|
| A. | 足量SO2通入NaClO溶液中发生反应的离子方程式为:H2O+SO2+ClO﹣=HClO+HSO3﹣ |
|
| B. | 向氯水中加入NaHCO3,可以增大氯水中次氯酸的浓度 |
|
| C. | 常温下,相同物质的量浓度的H2SO3、H2CO3、HClO溶液,pH最大的是H2SO3 |
|
| D. | NaHSO3溶液中离子浓度大小顺序为:c(Na+)>c(H+)>c(HSO3﹣)>c(SO32﹣)>c(OH﹣) |
查看答案和解析>>
科目:高中化学 来源: 题型:
高锰酸钾是常用的氧化剂。工业上以软锰矿(主要成分是MnO2)为原料制备高锰酸钾晶体。中间产物为锰酸钾。下图是实验室模拟制备的操作流程:

相关资料:
①物质溶解度
| 物质 | KMnO4 | K2CO3 | KHCO3 | K2SO4 | CH3COOK |
| 20℃溶解度 | 6.4 | 111 | 33.7 | 11.1 | 217 |
②锰酸钾
外观性状:墨绿色结晶。其水溶液呈深绿色,这是锰酸根(MnO42—)的特征颜色。
化学性质:在强碱性溶液中稳定,在酸性、中性和弱碱性环境下,MnO42—会发生歧化反应。
试回答下列问题:
(1)煅烧软锰矿和KOH固体时,不采用石英坩埚而选用铁坩埚的理由是______________;
实验中用铁坩埚煅烧暴露在空气中的固体混合物发生反应的化学方程式为_______。
(2)实验时,若CO2过量会生成KHCO3,导致得到的KMnO4产品的纯度降低。请写出实验中通入适量CO2时体系中可能发生反应离子方程式 : ;
其中氧化还原反应中氧化剂和还原剂的质量比为_________________________。
(3)由于CO2的通人量很难控制,因此对上述实验方案进行了改进,即把实验中通CO2改为加其他的酸。从理论上分析,选用下列酸中________ ,得到的产品纯度更高。
A.醋酸 B.浓盐酸 C.稀硫酸
 (4)工业上一般采用惰性电极电解锰酸钾溶液制取高锰酸钾,试写出该电解反应的化学方程式_______________________________________;
(4)工业上一般采用惰性电极电解锰酸钾溶液制取高锰酸钾,试写出该电解反应的化学方程式_______________________________________;
传统工艺采用无膜电解法由于副反应发生,Mn元素利用率和电流效率都会偏低。有同学联想到离子交换膜法电解饱和食盐水提出改进方法:可用阳离子交换膜分隔两极区进行电解(如图)。
图中A口加入的溶液最好为__________。
使用阳离子交换膜可以提高Mn元素利用率的原因为___________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在298 K时,实验测得溶液中的反应:H2O2+2HI====2H2O+I2,在不同浓度时的化学反应速率见下表,由此可推知当c(HI)=0.500 mol·L-1,c(H2O2)=0.400 mol·L-1时的反应速率为( )
| 实验编号 | 1 | 2 | 3 | 4 | 5 |
| c(HI)/mol·L-1·min-1 | 0.100 | 0.200 | 0.300 | 0.100 | 0.100 |
| c(H2O2)/mol·L-1·min-1 | 0.100 | 0.100 | 0.100 | 0.200 | 0.300 |
| v/mol·L-1·s-1 | 0.007 60 | 0.015 3 | 0.022 7 | 0.015 1 | 0.022 8 |
A.0.038 0 mol·L-1·s-1 B.0.152 mol·L-1·s-1
C.0.608 mol·L-1·s-1 D.0.760 mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
某探究小组用测量HNO3与大理石反应过程中质量减小的方法,研究影响反应速率的因素。限选试剂: 1.00 mol·L-1 HNO3、2.00 mol·L-1
HNO3,细颗粒大理石、粗颗粒大理石,35 ℃水浴。
(1)他们能完成哪些因素对速率影响的探究?
__________________________________________________________________。
(2)请根据能进行的探究内容,填写以下实验设计表,完成探究实验:
| 实验编号 | T/℃ | 大理石规格 | HNO3浓度/mol·L-1 |
| ① | 常温 | 2.00 | |
| ② | 1.00 | ||
| ③ | 2.00 | ||
| ④ | 2.00 |
(3)整个实验中应控制的不变量是硝酸溶液体积和________。
(4)该实验小组用如图实验装置进行实验。

①除电子天平、干燥管、锥形瓶、药匙、胶塞等仪器外,必需的实验仪器还有__________。
②干燥管中应放置的试剂是______。
A.碱石灰 B.无水CaCl2
C.P2O5固体 D.浓硫酸
③若撤除干燥管装置,所测速率________(填“偏大”“偏小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是(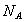 代表阿伏加德罗常数值)
代表阿伏加德罗常数值)
A. 1molNa被完全氧化为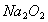 ,失去的电子数为2
,失去的电子数为2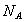
B. 常温常压下,16g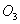 气体含有氧原子数为
气体含有氧原子数为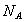
C. 常温常压下,22.4L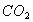 含有的分子数为
含有的分子数为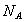
D. 18g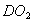 所含的电子数为10
所含的电子数为10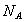
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于反应能量的说法正确的是( )
A.Zn(s)+CuSO4(aq)====ZnSO4(aq)+Cu(s) ΔH=-216 kJ·mol-1,反应物总能量<生成物总能量
B.相同条件下,如果1 mol氢原子所具有的能量为E1,1 mol 氢分子的能量为E2,则2E1>E2
C.101 kPa时,2H2(g)+O2(g)====2H2O(g) ΔH=-483.6 kJ·mol-1, H2的燃烧热为241.8 kJ·mol-1
D.H+(aq)+OH-(aq)====H2O(l) ΔH=-57.3 kJ·mol-1,含1 mol NaOH的氢氧化钠溶液与含0.5 mol H2SO4的浓硫酸混合后放出57.3 kJ 的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法中,正确的是( )
A.在化学反应过程中,发生物质变化的同时不一定发生能量变化
B.破坏反应产物全部化学键所需要的能量大于破坏反应物全部化学键所需要的能量时,反应为吸热反应
C.反应产物的总焓大于反应物的总焓时,反应吸热,ΔH>0
D.ΔH的大小与热化学方程式的计量系数无关
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com