
(14分)氢能以其洁净、高效、高热值、环境友好等特点成为最有前途的新能源,制氢和储氢的方法有很多。
(1)下图所示电化学装置工作时均与H2有关。

①图A所示装置可用于电解K2MnO4制KMnO4,通电一段时间后阴极附近溶液的pH将会 (填“增大”、“减小”或“不变”) 。
②图B所示装置为吸附了氢气的纳米碳管等材料制作的二次电池的原理,
开关连接用电器时,镍电极发生 (填“氧化”或“还原”)反应;开关连接充电器时,阳极的电极反应为 。
(2)热化学循环法制氢。已知:
①2Br2(g)+2CaO(s) == 2CaBr2(s)+O2(g) △H= —146kJ·mol—1
②3FeBr2(s)+4H2O(g) == Fe3O4(s)+6HBr(g)+H2(g) △H= +384kJ·mol—1
③CaBr2(s)+H2O(g) == CaO(s)+2HBr(g) △H= +212kJ·mol—1
④Fe3O4(s)+8HBr(g) == Br2(g)+3FeBr2(s)+4H2O(g) △H= —274kJ·mol—1
则2H2O(g) == 2H2(g)+O2(g)的△H= kJ·mol—1。
(3)光电化学分解制氢,原理如图所示,钛酸锶光电极的电极反应为4OH–– 4e–===O2+2H2O,则铂电极的电极反应为 。

(4)生物质制氢,若将生物质气化炉中出来的气体[主要有CH4、CO2、H2O(g)、CO及H2]在1.01×105Pa下进入转换炉,改变温度条件,各成分的体积组成关系如下图所示。下列有关图像的解读正确的是 。

A.利用CH4与H2O(g)及CO2转化为合成气CO和H2理论上是可行的
B.CH4(g)+CO2(g)→2CO(g)+2H2(g)和CH4(g)+H2O(g) → CO(g)+3H2(g),都是放热反应
C.CH4与CO2及H2O(g)转化为合成气CO和H2的适宜温度约为900℃
D.图像中曲线的交点处表示反应达到平衡
(5)LiBH4具有非常高的储氢能力,分解时生成氢化锂和两种单质,试写出该分解反应的化学方程式 。
19.(14分)(1)① 增大 ② 还原;Ni(OH)2+OH——e—== NiO(OH)+H2O
(2)+498 (3)2H2O+2e—== H2↑+2OH—或2H++2e—== H2↑
(4)AC (5)2LiBH4==2LiH+2B+3H2↑
【解析】
试题分析:(1)①电解K2MnO4制KMnO4,锰元素由+6价升高到+7价,失电子,做阳极,阴极反应式为2H++2e-=H2↑, 则阴极附近溶液的pH将会增大;②开关连接用电器时是原电池,电极反应为:NiO(OH)+e-+H2O =Ni(OH)2+OH-,发生还原反应;开关连接充电器时是电解池,阳极发生氧化反应,电极反应Ni(OH)2+OH——e—== NiO(OH)+H2O;
(2)①2Br2(g)+2CaO(s) == 2CaBr2(s)+O2(g) △H= —146kJ·mol—1
②3FeBr2(s)+4H2O(g) == Fe3O4(s)+6HBr(g)+H2(g) △H= +384kJ·mol—1
③CaBr2(s)+H2O(g) == CaO(s)+2HBr(g) △H= +212kJ·mol—1
④Fe3O4(s)+8HBr(g) == Br2(g)+3FeBr2(s)+4H2O(g) △H= —274kJ·mol—1
根据盖斯定律[①×1/2+②+③+④]×2得到△H=+498则2H2O(g) == 2H2(g)+O2(g) △H=+498 kJ·mol—1;
(3)依据装置图中的电子流向分析,铂电极做原电池正极,溶液中氢离子得到电子生成氢气,电极反应为:2H2O+2e-=H2↑+2OH-;
(4)A.图象分析可知随温度升高,甲烷、二氧化碳、水蒸气减小,一氧化碳、氢气增多,所以利用CH4与H2O(g)及CO2转化为合成气CO和H2理论上是可行的,A正确;B.依据图象分析,随温度升高,甲烷、二氧化碳、水蒸气减小,一氧化碳、氢气增多,升温平衡正向进行,CH4(g)+CO2(g)→2CO(g)+2H2(g)和CH4(g)+H2O(g)→CO(g)+3H2(g),都是吸热反应,B错误;C.图象分析可知在900°C时,二氧化碳甲烷反应最彻底,生成一氧化碳和氢气的量最大,CH4与CO2及H2O(g)转化为合成气CO和H2适宜温度约900℃,C正确;D.图象中曲线的交点处表示的是物质含量相同,但反应不一定达到平衡,D错误;选AC。
(5)LiBH4由于具有非常高的储氢能力,分解时生成氢化锂和两种单质,依据元素化合价变化和原子守恒分析可知,生成物中是氢气和硼单质,依据原子守恒写出分析方程式为:2LiBH4=2LiH+2B+3H2↑,答案为:2LiBH4=2LiH+2B+3H2↑.
考点:考查电解的应用,原电池电解反应,盖斯定律的应用,化学方程式书写等知识。


科目:高中化学 来源:2014-2015学年陕西省高三上学期第二次模考试化学试卷(解析版) 题型:选择题
等质量的CuO和MgO粉末分别在相同体积的硝酸中完全溶解,得到的Cu(NO3)2和Mg(NO3)2溶液的浓度分别为a mol·L-1和bmol·L-1,则a与b的关系为
A.a=b B.a=2b C.2a=b D.a=5b
查看答案和解析>>
科目:高中化学 来源:2014-2015学年辽宁省高三上学期期中化学试卷(解析版) 题型:选择题
下列说法正确的是:
A、标准状况下,33.6 L SO3中含有的氧原子数是4.5NA
B、1 mol OH-和1 mol—OH(羟基)中含有的电子数均为9NA
C、在加热条件下,100 mL18.4 mol/L的浓硫酸与足量金属铜反应得到的SO2的分子数为0.92 NA
D、当0.2 mol Na218O2与足量CO2完全反应后,生成碳酸钠的质量为21.6 g
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省赣州市十二县高三上学期期中化学试卷(解析版) 题型:选择题
根据表中信息判断,下列选项不正确的是
序号 | 反应物 | 产物 |
① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4… |
② | Cl2、FeBr2 | FeCl3、FeBr3 |
③ | MnO | Cl2、Mn2+… |
A.第①组反应的其余产物为H2O和O2
B.第②组反应中Cl2与FeBr2的物质的量之比为1∶2
C.第③组反应中生成1 mol Cl2,转移电子2 mol
D.氧化性由强到弱顺序为MnO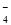 >Cl2>Fe3+>Br2
>Cl2>Fe3+>Br2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省赣州市十二县高三上学期期中化学试卷(解析版) 题型:选择题
设NA表示阿伏加德罗常数的值,下列有关NA 的叙述中不正确的有
A.标准状况下,20 g重水(D2O)中含有的电子数为10NA
B.乙烯和环丙烷组成的42 g混合气体中氢原子的个数为6NA
C.22.4 L的N2的共用电子对数为3NA
D.78gNa2O2固体中含有的阴离子数为NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省泰州市姜堰区高三上学期期中化学试卷(解析版) 题型:选择题
亚硝酸钠(NaNO2)是一种工业用盐,广泛用于物质合成、金属表面处理等,它的一些性质见下图。下列说法不正确的是

A.NH4NO2的热稳定性大于NaNO2
B.NaN3分解,每产生1molN2转移6mole-
C.NaN3可用氨基钠(NaNH2)和N2O在液氨中低温制备,N2O与N3—互为等电子体
D.可用淀粉碘化钾试纸和食醋鉴别NaCl与NaNO2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省泰州市姜堰区高三上学期期中化学试卷(解析版) 题型:选择题
下列离子方程式正确的是
A.Fe和稀硫酸反应:2Fe+6H+== 2Fe3++3H2↑
B.Na2O2溶于水产生O2:Na2O2+H2O == 2Na++2OH–+O2↑
C.用石墨做电极电解饱和MgCl2溶液:2Cl–+2H2O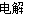 Cl2↑+H2↑+2OH–
Cl2↑+H2↑+2OH–
D.强碱溶液中NaClO与Fe(OH)3反应生成Na2FeO4:4OH–+3ClO–+2Fe (OH)3 == 2FeO42–+3Cl–+5H2O
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列对物质的结构组成表示恰当的是
| A.H2O2的结构式:H—O—H—O |
B.硫离子的结构示意图: |
C.二氧化碳的比例模型: |
| D.氧化铁的化学式: FeO |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列关于阿伏加德罗常数的说法不正确的是( )
| A.阿伏加德罗常数是一个纯数,没有单位 |
| B.常用NA表示阿伏加德罗常数 |
| C.阿伏加德罗常数是一个实验值 |
| D.阿伏加德罗常数常用:6.02×1023mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com