
| ������ | ��̿���ڸ��������»�ԭCuO |
| ������ | ��ⷨ����ӦΪ2Cu+H2O$\frac{\underline{\;���\;}}{\;}$Cu2O+H2���� |
| ������ | ���£�N2H4����ԭ����Cu��OH��2 |
���� ��1����̼����CuO��Ӧ�û���Cu��
�ڸ��ݸ�˹���ɣ�����֪�Ȼ�ѧ����ʽ�����ʵ���ϵ�����мӼ�����Ŀ���Ȼ�ѧ����ʽ����Ӧ��Ҳ������Ӧ��ϵ������Ӧ�ļӼ���
��2��4CuSO4+3H3PO2+6H2O=4CuH��+4H2SO4+3H3PO4���÷�Ӧ���ǻ�ԭ����ÿ1molH3PO2��ȫ������H3PO4��ת��4mol���ӣ�ͬʱ����$\frac{4}{3}$molCuH������ʵ��ת�Ƶ�����Ŀ����CuH�����ʵ�����
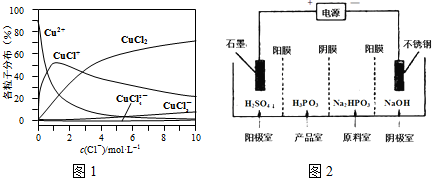
��3���ٴ�ͼ����c��Cl-��=9mol•L-1������һ��ƽ������������ߣ����ԱȽϣ�
�ڴ�ͼ����c��Cl-��=1mol•L-1������һ��ƽ������������ߣ�����������ࣻ
��4����ͭ����ˮ������������ͭ�������ӣ����ݳ����ܶȻ���������Һ�����ӻ��������㣻
�ڲ�Ʒ����HPO32-�������ӽ�� ���������ᣮ
��� �⣺��1���ٷ�����Ӧ���������ƣ������²���̼��CuO�����û���Ӧ����Cu��ʹCu2O���ʽ��ͣ�
�ʴ�Ϊ����Ӧ�����ƣ���ԭ����Cu��
����֪����2Cu��s��+$\frac{1}{2}$O2��g��=Cu2O��s������H=-169kJ•mol-1��
��C��s��+$\frac{1}{2}$O2��g��=CO��g������H=-110.5kJ•mol-1��
��Cu��s��+$\frac{1}{2}$O2��g��=CuO��s������H=-157kJ•mol-1
�ɸ�˹���ɿ�֪����-�ۡ�2+�ڵ�2CuO��s��+C��s��=Cu2O��s��+CO��g������H=��-169kJ•mol-1��-��-157kJ•mol-1����2+��-110.5kJ•mol-1��=+34.5kJ•mol-1��
�ʴ�Ϊ��+34.5��
��2����4CuSO4+3H3PO2+6H2O=4CuH��+4H2SO4+3H3PO4���÷�Ӧ���ǻ�ԭ����ÿ1molH3PO2��ȫ������H3PO4��ת��4mol���ӣ�ͬʱ����$\frac{4}{3}$molCuH����ת�Ƶ�����Ϊ3mol�����ɵ�CuH�����ʵ���Ϊ$\frac{4}{3}$mol��$\frac{4}{3}$=1mol��
�ʴ�Ϊ��1mol��
��3������c��Cl-��=9mol•L-1������һ��ƽ������������ߣ��ɼ���Һ����Ҫ��ͭ����Ũ�ȴ�С��ϵΪ��c��CuCl2����c��CuCl+����c��CuCl3-����c��Cu2+����c��CuCl42-����
�ʴ�Ϊ��c��CuCl2����c��CuCl+����c��CuCl3-����
�ڴ�ͼ�Ͽɼ�����c��Cl-��=1mol•L-1���Ȼ�ͭ��Һ�У���Ҫ��Cu2+��Cl-�������CuCl+��������������������Ũ���½�������ʽΪ��CuCl+�TCu2++Cl-���ʴ�Ϊ��CuCl+�TCu2++Cl-��
��4����ͭ����ˮ�����ӷ�ӦΪCu2++2H2O?Cu��OH��2+2H+��Ksp=c��Cu2+����c2��OH-��=2.0��10-20mol3•L-3����K=$\frac{{c}^{2}��{H}^{+}��}{c��C{u}^{2+}��}$=$\frac{{c}^{2}��{H}^{+}����{c}^{2}��O{H}^{-}��}{c��C{u}^{2+}����{c}^{2}��O{H}^{-}��}$=$\frac{K{w}^{2}}{Ksp}$=$\frac{��1{0}^{-14}��^{2}}{2.0��1{0}^{-20}}$=5��10-9��
�ʴ�Ϊ��5��10-9��
�ڲ�Ʒ����HPO32-�������ӽ�����������ᣬ��Ӧ���ӷ���ʽΪ��HPO32-+2H+=H3PO3���ʴ�Ϊ��HPO32-+2H+=H3PO3��
���� ���������ʵ��Ʊ�Ϊ���壬�����˹���ɵ�Ӧ�á�������ԭ��Ӧ�ļ��㡢���ԭ������Ӧ���ʼ��㡢��ѧƽ���뻯ѧ��Ӧ����Ӱ�����صȣ����ؿ���ѧ�������ݵķ��������������Ѷ��еȣ�


 �Ƹ�С״Ԫͬ������������ϵ�д�
�Ƹ�С״Ԫͬ������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ֱ���������Է�����3��̼ԭ��Ҳ��һ��ֱ���� | |
| B�� | ��ϩ����ԭ�Ӿ���ͬһƽ���� | |
| C�� | 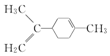 ����̼ԭ��һ����ͬһƽ���� ����̼ԭ��һ����ͬһƽ���� | |
| D�� |  ������16��ԭ�ӹ�ƽ�棬����8ԭ�ӹ��� ������16��ԭ�ӹ�ƽ�棬����8ԭ�ӹ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �٢ڢۢܢݢߢ� | B�� | �٢ܢߢ� | C�� | �٢� | D�� | �٢ܢݢߢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
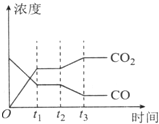 ���ܼ����ǵ��»����������ص㣮
���ܼ����ǵ��»����������ص㣮| H2O | CO | C02 | H2 | |
| n/mol | 0.20 | 0.20 | 0 | 0 |
| ������� | c��CO��/mol•L-1 | c��02��/mol•L-1 | c��C02��/mol•L-1 | V��������v���棩�Ƚ� |
| �� | 2.0��10-4 | 4.0��10-4 | 4.0��10-2 | V������=v���� |
| �� | 3.0��10-4 | 4.0��10-4 | 5.0��10-2 | V�������� v���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
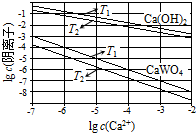 ��֪�������ƺ�����ƣ�CaWO4�������ܵ���ʣ����ߵ��ܽ�Ⱦ����¶����߶���С������ұ�������У����������Ƽ��������Ƽ�����Һ�еõ�����ƣ�������Ӧ
��֪�������ƺ�����ƣ�CaWO4�������ܵ���ʣ����ߵ��ܽ�Ⱦ����¶����߶���С������ұ�������У����������Ƽ��������Ƽ�����Һ�еõ�����ƣ�������Ӧ| �¶�/�� | 25 | 50 | 90 | 100 |
| K | 79.96 | 208.06 | 222.88 | 258.05 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��״���£�3.01��1023��CCl4��ռ�����ԼΪ11.2 L | |
| B�� | 80 g NH4NO3������Լ����NH4+ 6.02��1023�� | |
| C�� | 3.9 gNa2O2����������CO2ʱת�Ƶĵ�����Լ��3.01��1022 | |
| D�� | 46 g NO2��N2O4��������к���ԭ����ԼΪ1.806��1024 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ʳ�Ρ���ˮ | B�� | �ȡ��塢�� | C�� | �ơ�þ | D�� | �ռ���� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com