
【题目】常温下,Ksp(CaSO4)= 9×10-4,常温下CaSO4在水中的沉淀溶解平衡曲线如图所示。下列判断中正确的是

A. a点对应的溶液中c(H+)·c(OH-) 的数值为1×10-14
B. a 点对应的Ksp不等于c点对应的Ksp
C. b 点将有沉淀生成,平衡后溶液中c(SO42-)= 3×10-3mol/L,而向d 点溶液中加入适量的CaSO4固体可以变到c 点
D. CaSO4的饱和溶液中c(SO42-) > c(Ca2+) >c(H+) >c(OH-)
【答案】A
【解析】A、常温下,水的离子积常数为1×10-14,故a点对应的溶液中c(H+)·c(OH-) =Kw=1×10-14,选项A正确;B、Ksp是一常数,温度不变Ksp不变,在曲线上的任意一点Ksp都相等,选项B错误;C、d根据图示数据,可以看出b点Qc=2×l0-5>Ksp,所以会生成沉淀,平衡向生成沉淀的方向进行,此时溶液中c(SO42-)会小于4×l0-3mol/L,由于c(Ca2+)>c(SO42-),则c(SO42-)小于3×l0-3mol/L;升高温度,有利于溶解平衡正向移动,所以硫酸根的浓度会增大,向d 点溶液中加入适量的CaSO4固体不能变到c 点,选项C错误;D、CaSO4是强酸强碱盐,不水解,溶液呈中性,故CaSO4的饱和溶液中c(SO42-) = c(Ca2+) >c(H+) =c(OH-),选项D错误。答案选A。


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:
【题目】)硫酸钙来源于烟气脱硫、磷酸盐工业和其他工业的副产品,可用于生成硫酸及其硫化物等。硫酸钙在高温下被CO还原,发生的反应有:
I.CaSO4(s)+4CO(g) ![]() CaS(s)+4CO2(g) △Hl 平衡常数K1
CaS(s)+4CO2(g) △Hl 平衡常数K1
II.CaSO4(s)+CO(g) ![]() CaO(s)+SO2(g)+CO2(g) △H2 平衡常数K2
CaO(s)+SO2(g)+CO2(g) △H2 平衡常数K2
III.3CaSO4(s)+CaS(s) ![]() 4CaO(s)+4SO2(g) △H3=+1049.2kJ/mol 平衡常数K3
4CaO(s)+4SO2(g) △H3=+1049.2kJ/mol 平衡常数K3
(1)△H3=___(用△H1、△H2表示);平衡常数K3=_______(用K1、K2表示)。
(2)上述反应的平衡常数的对数值(lgK)与温度(T)的关系如下图所示:
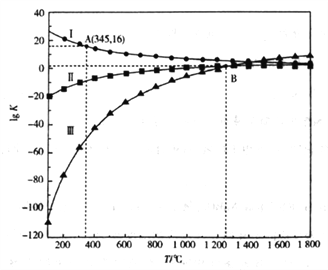
①△H1_________0(填”>”或”<")。
②若只发生反应I,A点c(CO)/c(CO2)=__________(填数值)。
③若只发生反应II和III,B点c(CO)、c(CO2)及c(SO2)之间的关系是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将0.1 mol镁和铝的混合物溶于100 mL 2 mol/L 稀硫酸中,然后滴加1 mol/L的NaOH溶液。若在滴加NaOH溶液的过程中,沉淀质量随加入NaOH溶液体积的变化如图所示,下列说法正确的是

A. 当V1=150 mL时,金属粉末中镁粉的质量分数为50%
B. 若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V(NaOH)=400mL。
C. 若其中镁粉的物质的量分数为a,用100 mL 2 mol/L稀硫酸溶解此混合物后,再加入450 mL 1 mol/L NaOH溶液,所得沉淀中无Al(OH)3,则a的取值范围为![]() <a<1
<a<1
D. 若在滴加NaOH溶液的体积为V2时,溶液中溶质为NaAlO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,满足表中图示物质在一定条件下一步转化关系的组合有
序号 | X | Y | Z | W |
|
① | Si | Na2SiO3 | H2SiO3 | SiO2 | |
② | Na | NaOH | Na2CO3 | NaCl | |
③ | Cl2 | Ca(ClO)2 | HClO | HCl | |
④ | Fe | FeCl3 | FeCl2 | Fe(OH)2 |
A. ①②③ B. ①③④ C. ②③ D. ①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将纯锌片和纯铜片按图示方式插入同浓度的稀硫酸中一段时间,以下叙述正确的是( ) 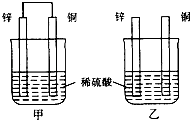
A.两烧杯中铜片表面均无气泡产生
B.甲中铜片是正极,乙中铜片是负极
C.两烧杯中溶液的pH均减小
D.产生气泡的速度甲比乙快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有(1)乙酸乙酯和乙酸钠溶液、(2)溴化钠和溴水的混合液,分离它们的正确方法依次是( )
A. 分液、萃取 B. 萃取、分液 C. 分液、蒸馏 D. 蒸馏、分液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2L的密闭容器中进行如下反应:A(g)+2B(g)3C(g)+nD(g),开始时A为4mol,B为6mol,5 min末时测得C的物质的量为3mol,用D表示的化学反应速率v(D)为0.2molL﹣1min﹣1 .
计算:
(1)5min末A的物质的量浓度,
(2)B的转化率为.
(3)前5min内用B表示的化学反应速率v(B).
(4)化学方程式中n值.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁在锈蚀过程中,下列5种变化可能发生的是( )
①Fe由+2价转化为+3价 ②O2被还原 ③产生H2④Fe(OH)3失水形成Fe2O3·H2O ⑤杂质C被氧化除去
A.①②
B.①②③④
C.③④
D.①②④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com