
| t/min | 0 | 2 | 4 | 6 | 8 | 10 |
| c(H2S)/mol/L | 1.00 | 0.80 | 0.62 | 0.48 | 0.40 | 0.40 |
| c(SO2)/mol/L | 1.00 | 0.90 | 0.81 | 0.74 | 0.70 | 0.70 |
分析 (1)已知:①2H2S(g)+3O2(g)=2H2O(l)+2SO2(g)△H=akJ/mol,
②2SO2(g)+O2(g)═2SO3(g)△H=b kJ/mol,
③SO3(g)+H2O(l)═H2SO4(l)△H=c kJ/mol,
结合盖斯定律,将①+②+③×2可得由H2S气体一步合成硫酸的热化学方程式;
(2)硫化氢与CuSO4溶液反应生成硫化铜沉淀和硫酸;FeS的溶度积比CuS大,结合沉淀的转化判断;
(3)①2H2S(g)+SO2(g)═3S(s)+2H2O(l)△H<0,为放热反应,如增大平衡常数,应使平衡正向移动;
②2~8分钟SO2浓度变化0.2mol/L,结合v=$\frac{△c}{△t}$计算;
③8min时浓度不变,说明达到平衡状态,确定各物质的平衡浓度,可计算平衡常数.
解答 解:(1)已知:①2H2S(g)+3O2(g)=2H2O(l)+2SO2(g)△H=akJ/mol,
②2SO2(g)+O2(g)═2SO3(g)△H=b kJ/mol,
③SO3(g)+H2O(l)═H2SO4(l)△H=c kJ/mol,
结合盖斯定律,将①+②+③×2可得2H2S(g)+4O2(g)═2H2SO4(l)△H=(a+b+2c)kJ/mol,可写为H2S(g)+2O2(g)═H2SO4(l)△H=$\frac{a+b+2c}{2}$kJ/mol,
故答案为:H2S(g)+2O2(g)═H2SO4(l)△H=$\frac{a+b+2c}{2}$kJ/mol;
(2)硫化氢与CuSO4溶液反应生成硫化铜沉淀和硫酸,反应的离子发生为Cu2++H2S═CuS↓+2H+,FeS的溶度积比CuS大,加入FeS,可使溶液中铜离子生成CuS,
故答案为:Cu2++H2S═CuS↓+2H+; 能;
(3)①2H2S(g)+SO2(g)═3S(s)+2H2O(l)△H<0,为放热反应,如增大平衡常数,应使平衡正向移动,则应降低温度,故答案为:降低温度;
②2~8分钟SO2浓度变化0.2mol/L,v=$\frac{△c}{△t}$=$\frac{0.2mol/L}{6min}$=0.033mol/(L•min)或$\frac{1}{30}$mol/(L•min),
故答案为:0.033mol/(L•min)或$\frac{1}{30}$mol/(L•min);
③2H2S(g)+SO2(g)═3S(s)+2H2O(l)
起始:1 1
平衡:0.4 0.7
由于S为固体,水为液体,则K=$\frac{1}{{c}^{2}({H}_{2}S)×c(S{O}_{2})}$=8.93(L/mol)3或$\frac{1}{0.112}$(L/mol)3,
故答案为:8.93(L/mol)3或$\frac{1}{0.112}$(L/mol)3
点评 本题考查较为综合,涉及盖斯定律的运用、难溶电解质的溶解平衡以及平衡的计算,为高频考点,侧重于学生的分析、计算能力的考查,易错点为(3),注意平衡常数的计算,难度中等.


科目:高中化学 来源: 题型:选择题
| A. | CaCO3+2HCl═CaCl2+H2O+CO2↑ | B. | 2KMnO4$\frac{\underline{\;\;△\;\;}}{\;}$K2MnO4+MnO2+O2↑ | ||
| C. | CaO+H2O═Ca(OH)2 | D. | CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molC2H6中含有6 NA个共价键 | |
| B. | 7.8 g Na2O2中含有的阳离子数和阴离子数均为0.2NA | |
| C. | 14.0g由C2H4和C3H6组成的混合气体原子总数为3NA | |
| D. | 5.6g金属铁与足量盐酸反应时失去的电子数是0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2L苯中含有分子的数目为0.5NA | |
| B. | 常温常压下,5.6g乙烯(C2H4)与丁烯(C4H8)的混合物中含有的氢原子的数目为0.8NA | |
| C. | 在50 g质量分数为46%的乙醇水溶液中,含有的氢原子总数为3NA | |
| D. | 1mol Fe与足量的稀硫酸反应转化为Fe3+失去的电子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
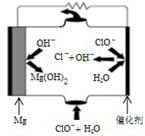 利用所学知识回答下列问题
利用所学知识回答下列问题| K1 | K2 | |
| H2SO3 | 1.3×10-2 | 1.0×10-7 |
| H2CO3 | 4.2×10-7 | 5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgCl、Ag2C2O4、AgI三者的饱和溶液中c(Ag+)大小顺序:Ag2C2O4>AgCl>AgI | |
| B. | 将0.02 mol•L-1AgNO3溶液和0.02 mol•L-1 Na2SO4溶液等体积混合,有沉淀生成 | |
| C. | 向5mL饱和AgCl溶液中滴加0.5mL 0.1 mol•L-1KI溶液,无沉淀生成 | |
| D. | 向浓度均为0.1mol•L-1NaCl和KI混合溶液中滴加AgNO3溶液,先有白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
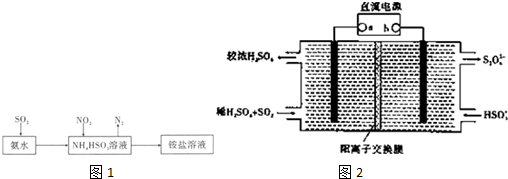
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com