
.类推的思维方法在化学学习与研究中有时会产生错误结论,因此类推的结论最终要经过实践的检验,才能决定其正确与否,下列几种类推结论中,错误的是
①钠与水反应生成NaOH和H2;所有金属与水反应都生成碱和H2
②铁露置在空气中一段时间后就会生锈;性质更活泼的铝不能稳定存在于空气中
③化合物NaCl的焰色为黄色;Na2CO3的焰色也为黄色
④密度为1.1 g·cm-3与密度为1.2 g·cm-3的NaCl溶液等体积混合,所得NaCl溶液的密度介于1.1 g·cm-3与1.2 g·cm-3之间,Na-K合金的熔点应介于Na和K熔点之间
A.①② B.①④ C.①②③④ D.①②④
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
次氯酸钠(NaClO)和藏氯酸钠(NaClO)都是重要的含氯消毒剂。
(l) NaClO2中,氯元素的化合价为________。
(2)某同学在实验室探究并制作一种家用环保型消毒液(NaClO)发生器,设计了如图的装置,用石墨作电极电解饱和氯化钠溶液。
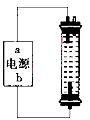
①通电时,为使Cl2被完全吸收,制得有较强杀菌能力的消毒液,则电源有b电极名称为_________(填“正”、“负”、“阴”或“阳”)投。
②装置中发生反应的有关化学方程式为________; 充分电解后溶液中各离子浓度由大到小顺序为____________。
③请说出使用该装置生产消毒液的一个优点和一个注意事项____ 。
(3)化学课外活动小组为测定某品牌“84消毒液”中NaClO的含量(单位体积溶液含有 NaCIO的质量),做了如下实验。已知:
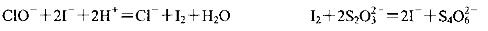
取10 mL该消毒液于锥形瓶中,迅速加入适量的硫酸酸化的碘化钾溶液,密封、充分
混合,暗处放置几分钟。然后加入几滴淀粉溶液,用c mol/L的硫代硫酸钠(Na2S2O3)
标准溶液滴定,平均用去VmL硫代硫酸钠溶液。则该“84消毒液”中NaCIO的含量
为_________g/mL(用含c、V的式子表示)。
(4)以下是过氧化氢法生产亚氯酸钠的工艺流程图:
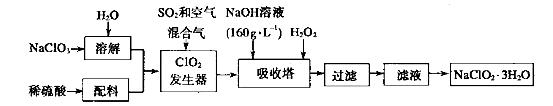
己知:(i)NaClO2 的溶解度随温度升高而增大,适当条件下可结晶析出: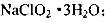
(ii)纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下较安全;
(iii) HClO2可看成是强酸。
①发生器中发生反应的离子方程式为___________________在发生器中鼓入空气的作用可能是__________________。
②吸收塔内的反应的化学方程式为__________________。在吸收塔中为防止被还原成NaCI,所用还原剂的还原性应适中。除外,还可以选择的还原剂_________(填序号)。
A.Na2O2 B.Na2S C.FeCl2
③从滤液中得到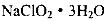 粗晶体的实验操作依次是_________(填序号)。
粗晶体的实验操作依次是_________(填序号)。
A.蒸馏 B.蒸发 C.灼烧 D.过滤 E.冷却结晶
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表格中的各种情况,可以用下面的图象曲线表示的是( )
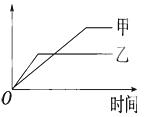
| 反应 | 纵坐标 | 甲 | 乙 | |
| A | 等质量的钾、钠分别与足量水反应 | H2质量 | 钠 | 钾 |
| B | 相同质量氨,在同一容器中2NH3 | 氨气的转化率 | 500℃ | 400℃ |
| C | 在体积可变的恒压容器中,体积比1:3的N2、H2,2NH3 | 氨气的浓度 | 活性高的催化剂 | 活性一般的催化剂 |
| D | 2molSO2与1molO2,在相同温度下2SO2+O2 | SO3物质的量 | 10个大气压 | 2个大气压 |
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,将一定量的钠铝合金置于水中,合金全部溶解,得到20 mL pH=14的溶液,然后用1 mol/L的盐酸滴定,测得生成沉淀的质量与消耗盐酸的体积关系如图所示,则下列说法正确的是
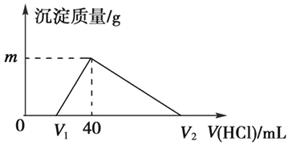
A.原合金质量为 0.92 g B.产生氢气的体积为896 mL(标准状况下)
C.图中m的值为1.56 D.图中V2的值为60
查看答案和解析>>
科目:高中化学 来源: 题型:
将0.02 mol Na别投入到盛有100 mL水、100 mL 1mol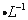 盐酸、100 mL 1mol
盐酸、100 mL 1mol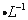 硫酸铜溶液的X、Y、Z三个烧杯中,下列有关说法错误的是( )。
硫酸铜溶液的X、Y、Z三个烧杯中,下列有关说法错误的是( )。
A.三个烧杯中一定均会发生的离子反应有:2Na+2H2O==2Na++2OH—+H2↑
B.三个烧杯中钠均在液面上剧烈反应,相比而言,X烧杯中的反应平缓些
C.Z烧杯中一定会有沉淀生成,但沉淀不是单质铜
D.三个烧杯中生成氢气体的物质的量相同
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)已知A和B均为第3周期元素,其原子的第一至第四电离能如下表所示:
| 电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
| A | 578 | 1 817 | 2 745 | 11 578 |
| B | 738 | 1 451 | 7 733 | 10 540 |
A通常显________价,A的电负性________B的电负性(填“>”“<”或“=”)。
(2)紫外光的光子所具有的能量约为399 kJ·mol-1。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因____________________________________。
| 共价键 | C—C | C—N | C—S |
| 键能/kJ·mol-1 | 347 | 305 | 259 |
组成蛋白质的最简单的氨基酸中的碳原子杂化类型是__________。
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图所示),其中3种离子晶体的晶格能数据如下表:
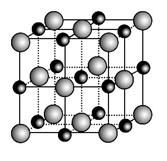
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ·mol-1 | 786 | 715 | 3 401 |
则该4种离子晶体(不包括NaCl)熔点从高到低的顺序是:________________。
其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有__________个。
(4)金属阳离子含有的未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是__________。
(5)某配合物的分子结构如图所示,其分子内不含有________(填序号)。
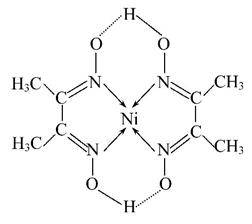
A.离子键 B.极性键 C.金属键 D.配位键
E.氢键 F.非极性键
(6)科学家设计反应:CO2+4H2→CH4+2H2O以减小空气中的CO2。
若有1 mol CH4生成,则有______molσ键和______molπ键断裂。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知HF、CH3COOH均为弱酸,酸性强弱顺序为HF>CH3COOH,下列说法正确的是( )
A.浓度均为0.1 mol·L-1的NaF、CH3COONa溶液相比较,CH3COONa溶液碱性较强
B.0.1 mol·L-1 CH3COOH溶液,加水稀释过程中,所有离子浓度均减小
C.NaF溶液中只含有Na+、F-、H+、OH-、H2O五种微粒
D.NaF溶液中加入少量NaOH固体,溶液中c(F-)变小
查看答案和解析>>
科目:高中化学 来源: 题型:
将含O2和CH4的混合气体充入有23.4g Na2O2的密闭容器中,电火花点燃,反应结束后,容器内于150℃时压强约为0.将残留物溶于水,无气体逸出.
(1)原混合气体中O2和CH4体积比为
(2)残留固体成分
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com