
| A. | 属于芳香烃 | B. | 是高分子化合物 | ||
| C. | 可使溴水和酸性高锰酸钾溶液褪色 | D. | 苯环上的一氯取代物有5种 |
科目:高中化学 来源: 题型:选择题
| A. | 含有2个羧基 | B. | 含有1个甲基 | ||
| C. | 含有2个羟基 | D. | 同时含有1个羟基和1个醛基 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
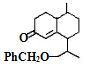
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:r(N)>r(M)>r(Y)>r(X) | |
| B. | X与Y形成的化合物溶于水,溶液显碱性 | |
| C. | 简单气态氢化物的热稳定性:M>N>X | |
| D. | 单质的熔点:Y>N>M>X |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
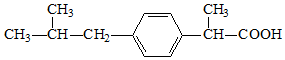
| A. | 布洛芬的分子式为C13H18O2 | |
| B. | 布洛芬与苯乙酸是同系物 | |
| C. | 1mol 布洛芬最多能与3mol 氢气发生加成反应 | |
| D. | 布洛芬在苯环上发生取代反应,其一氯代物有4种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 结论 |
| A | 向稀硝酸中加入过量的铁粉充分反应后,滴入KSCN溶液 | 溶液变为血红色 | HNO3具有氧化性,能将Fe氧化成Fe3+ |
| B | 向盛有某溶液的试管中滴加NaOH溶液,将湿润的红色石蕊试纸置于试管口 | 试纸颜色无明显变化 | 原溶液中无NH4+ |
| C | 向淀粉溶液中加入稀硫酸,加热,冷却后加入新制Cu(OH)2,再加热 | 未见红色沉淀 | 淀粉未发生水解 |
| D | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体 | 溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
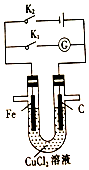
| A. | 同时打开K1、K2,铁棒上有紫红色物质析出 | |
| B. | 只闭合K1,石墨棒上有紫红色物质析出 | |
| C. | 只闭合K2,当电路中通过0.3mol电子时,两极共产生4.48L(标准状况)气体 | |
| D. | 只闭合K2,一段时间后,将电解质溶液搅拌均匀,溶液的pH变大(不考虑Cl2的溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素代号 | 相关信息 |
| A | A的单质能与冷水剧烈反应,得到强碱性溶液 |
| B | B的原子最外层电子数是其内层电子数的三倍 |
| C | 在第3周期元素中,C的简单离子半径简单最小 |
| D | A、B、D组成的36电子的化合物X是家用消毒剂的主要成分 |
| E | 所有有机物中都含有E元素 |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com