
| A. | 丙烯与丁烯 | B. | 丙烷与丁炔 | C. | 乙烯与乙炔 | D. | 乙烷与丙烯 |
分析 烃的燃烧反应中,燃烧相同质量的烃,烃中含碳的质量分数越大,生成的CO2量越多,然后利用极限法根据含碳量高低进行分析.
解答 解:A.丙烯和丁烯分子中C、H原子数目之比均为1:2,环丙烷C、H原子数目之比为1:2,燃烧相同质量的混合气体,所产生CO2的量等于燃烧相同质量的环丙烷所产生的CO2,故A不符合;
B.丙烷、丁炔分子中C、H原子数目之比分别为1:2.67、1:1.5,环丙烷C、H原子数目之比为1:2,燃烧相同质量的混合气体,所产生CO2的量可能大于、小于或等于燃烧相同质量的环丙烷所产生的CO2,故B不符合;
C.乙烯和乙炔中C、H原子数目之比分别为1:2、1:1,所以混合气体的含碳量大于环丙烷,燃烧相同质量的混合气体,所产生CO2的量一定大于燃烧相同质量的环丙烷所产生的CO2,故C符合;
D.乙烷和丙烯中C、H原子数目之比分别为1:3、1:2,乙烷的含碳量小于环丙烷,所以混合气体的含碳量小于环丙烷,燃烧相同质量的混合气体,所产生CO2的量一定小于燃烧相同质量的乙烯所产生的CO2,故D不符合,
故选:C.
点评 本题考查混合物计算、烃燃烧有关计算,难度中等,利用碳元素守恒,明确相同质量的烃燃烧时,烃中含碳的质量分数越大生成的CO2量越多.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 在Na2CO3溶液中:c(Na+):c(CO32-)=2:1 | |
| B. | 在25℃时,无论是酸性、碱性或中性溶液中,其c(H+)和c(OH-)的乘积都等于1×10-14 | |
| C. | 0.1mol/L的KOH溶液和0.1mol/L氨水中,c(OH-)相等 | |
| D. | 原电池的正极所发生的反应是氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
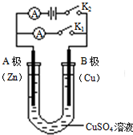 如右图所示,请按要求回答下列问题.
如右图所示,请按要求回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氨水吸收少量的二氧化硫:NH3•H2O+SO2═NH4++HSO3- | |
| B. | 硫酸亚铁溶液中加入过氧化氢溶液:Fe2++2H2O2+4H+═Fe3++4H2O | |
| C. | 次氯酸钙溶液中通入过量的二氧化碳:ClO-+H2O+CO2═HCO3-+HClO | |
| D. | 碳酸钠溶液中慢慢滴入少量稀盐酸:CO32-+2H+═CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量MgCl2、Ba(OH)2和HCl溶液混合:Mg2++3OH-+H+═Mg(OH)2↓+H2O | |
| B. | 由水电离出来的C(OH-)=10-13mol/L的溶液中加入铝粉:2Al+6H+═3H2↑+2Al3+ | |
| C. | 硝酸铁溶液中滴加足量HI溶液:Fe3++3NO3-+12H++10I-═Fe2++5I2↓+3NO↑+6H2O | |
| D. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2═2Mn2++5O2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
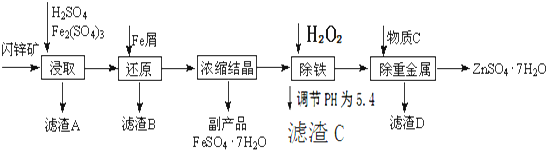

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com