
 2Z(g);△H<0,在不同温度(T1和T2)下,产物Z的物质的量n与反应时间t的关系如图所示,则下列判断中正确的是( )
2Z(g);△H<0,在不同温度(T1和T2)下,产物Z的物质的量n与反应时间t的关系如图所示,则下列判断中正确的是( )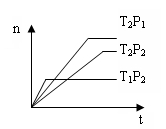
| A.T1<T2,P1<P2 | B.T1<T2,P1>P2 |
| C.T1>T2,P1>P2 | D.T1>T2,P1<P2 |
 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源:不详 题型:单选题
 2SO3(g) 是可逆反应的事实是
2SO3(g) 是可逆反应的事实是| A.O2仍为1mol | B.SO2仍为2mol |
| C.SO2完全转化为 SO3 | D.SO2、O2、 SO3同时存在 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 4NO(g)+6H2O(g),下列叙述正确的是( )
4NO(g)+6H2O(g),下列叙述正确的是( )| A.达到化学平衡时,4v正(O2)=5v逆(NO) |
| B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 |
| C.达到化学平衡时,NH3(g)、O2(g) NO(g)、H2O(g)的浓度比为4:5:4:6 |
| D.化学反应速率关系是:2v正(NH3)=3v正(H2O) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

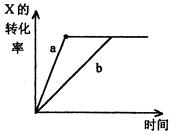
| A.减小Y的浓度 |
| B.增大Y的浓度 |
| C.降低温度 |
| D.减小反应体系的压强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.加压 | B.移走氨气 | C.使用催化剂 | D.充入N2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 C(g)+D(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是: ①混合气体的密度 ②容器内气体的压强 ③混合气体的总物质的量④B物质的量浓度
C(g)+D(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是: ①混合气体的密度 ②容器内气体的压强 ③混合气体的总物质的量④B物质的量浓度| A.①④ | B.②③ |
| C.②③④ | D.只有④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 pC(g)+qD(g)中,当m、n、p、q为任意正整数时,达到平衡的标志是( )
pC(g)+qD(g)中,当m、n、p、q为任意正整数时,达到平衡的标志是( )| A.体系压强不再发生变化 |
| B.各组分的物质的量浓度不再改变 |
| C.各组分的质量分数不再改变 |
| D.反应速率vA∶vB∶vC∶vD=m∶m∶p∶q |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 实验 序号 | 浓度
| 0 | 10 | 20 | 30 | 40 | 50 | 60 | ||
| 1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 | ||
| 2 | 800℃ | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 | ||
| 3 | 800℃ | C3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 | ||
| 4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 PC(g)+qD(g),右图表示A的转化率与压强、温度的关系。由此得出的正确结论是
PC(g)+qD(g),右图表示A的转化率与压强、温度的关系。由此得出的正确结论是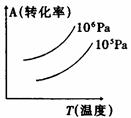
| A.正反应是吸热反应 |
| B.(m+n)<(p+q) |
| C.压强增大,A的转化率减小 |
| D.温度升高,A的转化率减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com