
有Fe2+、NO 、Fe3+、NH
、Fe3+、NH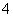 、H+和H2O六种粒子,属于同一氧化还原反应中的反应物和生成物,下列叙述不正确的是( )
、H+和H2O六种粒子,属于同一氧化还原反应中的反应物和生成物,下列叙述不正确的是( )
A.氧化剂和还原剂的物质的量之比为1∶8
B.该反应说明Fe(NO3)2溶液不宜加酸酸化
C.每1 mol NO 发生氧化反应,转移8 mol e-
发生氧化反应,转移8 mol e-
D.若把该反应设计为原电池,则负极反应为Fe2+-e-===Fe3+
科目:高中化学 来源: 题型:
下列8种符号: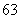 Li、
Li、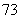 Li、
Li、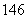 C、
C、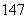 N、
N、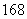 O、
O、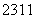 Na、
Na、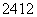 Mg、
Mg、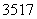 Cl
Cl
(1)包含________种元素,________种核素,其中互为同位素的是__________。
(2)氯离子的结构示意图为________。
(3)原子最外层电子数是次外层电子数2倍、3倍的分别是________、________。
(4)质量数相等的是________和________。
查看答案和解析>>
科目:高中化学 来源: 题型:
运用元素周期律分析下面的推断,其中错误的是( )
A.已知Ra是第七周期第ⅡA族的元素,故Ra(OH)2碱性比Mg(OH)2强
B.已知As是第四周期第ⅤA族的元素,故AsH3比NH3稳定
C.已知Cs的原子半径大于Na的原子半径,故Cs与水反应比Na与水反应更剧烈
D.已知Cl的核电荷数比Al大,故Cl的原子半径比Al的小
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是元素周期表短周期的一部分,下列说法中正确的是( )
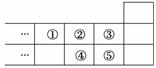
A.元素①位于第二周期第ⅣA族
B.气态氢化物的稳定性:④>②
C.最高价氧化物对应水化物的酸性:⑤>④
D.元素的最高正化合价:③=⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。完成下列填空:
(1)写出并配平CCl4层由紫色变成无色的化学反应方程式(如果化学计量数是1,不再填写):
 (2)整个过程中的还原剂是________。
(2)整个过程中的还原剂是________。
(3)把KI换成KBr,则CCl4层变为________色;继续滴加氯水,CCl4 层的颜色没有变化。则Cl2、HIO3、HBrO3氧化性由强到弱的顺序是____________________________________________________________。
(4)加碘盐中含碘量为20 mg·kg-1~50 mg·kg-1。制取加碘盐(含KIO3的食盐)1 000 kg,若用KI与Cl2反应制KIO3,至少需要消耗Cl2________ L(标准状况,保留2位小数)
查看答案和解析>>
科目:高中化学 来源: 题型:
某溶液中含有0.005 mol FeBr2及其他物质,向该溶液中通入134.4 mL标准状况下的Cl2,溶液中只有FeBr2与Cl2反应,则通入Cl2后溶液中可能大量存在的离子是( )
A.Fe2+、Fe3+、Br-、NO B.Fe2+、H+、NO
B.Fe2+、H+、NO 、K+
、K+
C.Fe3+、Br-、NO 、Cl- D.Fe2+、Br-、NO
、Cl- D.Fe2+、Br-、NO 、Cl-
、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
下列指定反应的离子方程式正确的是( )
A.Cu溶于稀HNO3:Cu+2H++NO ===Cu2++NO2↑+H2O
===Cu2++NO2↑+H2O
B.(NH4)2Fe(SO4)2溶液与过量NaOH溶液反应制Fe(OH)2:Fe2++2OH-===Fe(OH)2↓
C.用CH3COOH溶解CaCO3:CaCO3+2H+===Ca2++H2O+CO2↑
D.向NaAlO2溶液中通入过量CO2制Al(OH)3:CO2+AlO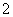 +2H2O===Al(OH)3↓+HCO
+2H2O===Al(OH)3↓+HCO
查看答案和解析>>
科目:高中化学 来源: 题型:
在5L的密闭容器中充入2molA气体和1molB气体,在一定条件下发生反应:
2A(g) + B(g) 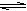 2C(g)达平衡时,在相同条件下测得容器内混合气体的压强是反应前的
2C(g)达平衡时,在相同条件下测得容器内混合气体的压强是反应前的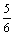 ,则A 的转化率为( )
,则A 的转化率为( )
A.67% B.50% C.25% D.5%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com