
| A. | 标准状况下,22.4 L的CCl4中C-Cl键数为为4NA | |
| B. | 常温下,1 L 0.1mol•L-1的NH4NO3溶液中氮原子数为0.2 NA | |
| C. | 在反应KIO3+6HI=KI+3I2+3H2O中,每生成3molI2转移的电子数为6 NA | |
| D. | 0.1mol乙酸与0.1mol乙醇反应生成乙酸乙酯的分子数为0.1NA |
分析 A、标况下四氯化碳为液体;
B、求出硝酸铵的物质的量,然后根据1mol硝酸铵中含2mol氮原子来分析;
C、反应KIO3+6HI=KI+3I2+3H2O转移5mol电子生成3mol碘单质;
D、酯化反应为可逆反应.
解答 解:A、标况下四氯化碳为液体,故不能根据气体摩尔体积来计算其物质的量,故A错误;
B、溶液中硝酸铵的物质的量n=CV=0.1mol/L×1L=0.1mol,而1mol硝酸铵中含2mol氮原子,故0.1mol硝酸铵中含0.2NA个氮原子,故B正确;
C、反应KIO3+6HI=KI+3I2+3H2O转移5mol电子生成3mol碘单质,极生成3mol碘单质时转移5NA个电子,故C错误;
D、酯化反应为可逆反应,不能进行彻底,故生成的乙酸乙酯的分子个数小于0.1NA个,故D错误.
故选B.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握物质的量的计算公式和物质结构是解题关键,难度不大.


科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 除去CO2中的少量HCl:通入NaOH溶液 | |
| B. | 除去KCl溶液中的少量K2CO3:加入适量的盐酸 | |
| C. | 向某无色未知溶液中仅加入BaCl2溶液,以检验未知溶液中的SO42- | |
| D. | 用BaCl2溶液,可将盐酸、硫酸、硫酸钠、氢氧化钠和硝酸钾五种无色溶液鉴别开 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
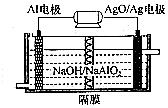 (1)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料.FeCl3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应为FeO42-+3eˉ+4H2O=Fe(OH)3+5OH-,该电池总反应的离子方程式为3Zn+2FeO42-+8H2O=3Zn(OH)2+2Fe(OH)3+4OH-.
(1)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料.FeCl3和KClO在强碱性条件下反应可制取K2FeO4,其反应的离子方程式为:2Fe3++3ClO-+10OH-=2FeO42-+3Cl-+5H2O;与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应为FeO42-+3eˉ+4H2O=Fe(OH)3+5OH-,该电池总反应的离子方程式为3Zn+2FeO42-+8H2O=3Zn(OH)2+2Fe(OH)3+4OH-.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当b>2a时,发生的离子反应为:CO32-+2H+=H2O+CO2↑ | |
| B. | 当b<a时,发生的离子反应为:CO32-+H+=HCO3- | |
| C. | 当4a=3b时,发生的离子反应为:3CO32-+4H+=2HCO3-+CO2↑+H2O | |
| D. | 当a<b<2a时,反应生成的HCO3-与CO2的物质的量之比为(b-a):(2b-a) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 纯净物 | 混合物 | 电解质 | 非电解质 | |
| A | 硫酸 | 水煤气 | 硫酸 | 铜 |
| B | 胆矾 | 碱石灰 | 硫酸钡 | NH3 |
| C | 纯碱 | 蔗糖溶液 | 氯化钠溶液 | 三氧化硫 |
| D | 冰醋酸 | 氢氧化铁胶体 | 苛性钾溶液 | 乙醇 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
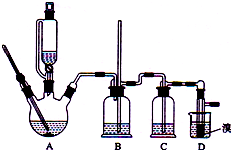 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g•cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com