
【题目】利用偏铝酸钠(NaA1O2)溶液电解法制备氢氧化铝的简易装置如图所示,其中两电极均为惰性电极。下列说法正确的是( )
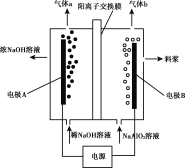
A.电极A为阳极
B.气体b为H2
C.所得料浆液的pH大于原料NaA1O2溶液的pH
D.该方法总反应方程式是:4NaA1O2+10H2O![]() 4A1(OH)3+4NaOH+O2↑+2H2↑
4A1(OH)3+4NaOH+O2↑+2H2↑
【答案】D
【解析】
电解NaA1O2溶液制备氢氧化铝,阳极A1O2-失去电子,发生氧化反应,电极反应式为:4A1O2--4e-+6H2O=O2↑+ 4A1(OH)3↓,阴极H+得到电子,发生还原反应,电极反应式为:4H2O+4e--=2H2↑+4OH-,总反应为:4NaA1O2+10H2O![]() 4A1(OH)3+4NaOH+O2↑+2H2↑。
4A1(OH)3+4NaOH+O2↑+2H2↑。
A. 阴极上H+得到电子,发生还原反应,其电极反应式为:4H2O+4e--=2H2↑+4OH-,碱性增强,有图像可知,电极A附近稀NaOH变为浓NaOH,碱性增强,则电极A为阴极,A错误;
B. 电极A为阴极,电极B为阳极,阳极上A1O2-失去电子,发生氧化反应,其电极反应式为:4A1O2--4e-+6H2O=O2↑+ 4A1(OH)3↓,气体b为O2,B错误;
C. 电极B上生成料浆液,电极B为阳极,阳极上A1O2-失去电子,发生氧化反应,其电极反应式为:4A1O2--4e-+6H2O=O2↑+ 4A1(OH)3↓,pH小于原料NaA1O2溶液的pH,C错误;
D. 该电解池总反应方程式是:4NaA1O2+10H2O![]() 4A1(OH)3+4NaOH+O2↑+2H2↑,D正确;故答案为:D。
4A1(OH)3+4NaOH+O2↑+2H2↑,D正确;故答案为:D。


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的的是
A. 用该装置分离乙酸乙酯与饱和碳酸钠溶液
用该装置分离乙酸乙酯与饱和碳酸钠溶液
B.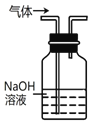 用该装置除去实验室制取乙烯中混有的少量 SO2
用该装置除去实验室制取乙烯中混有的少量 SO2
C.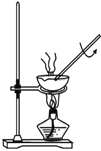 用该装置加热 AlCl3 溶液制备无水 AlCl3 固体
用该装置加热 AlCl3 溶液制备无水 AlCl3 固体
D.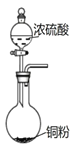 用该装置获取少量 SO2 气体
用该装置获取少量 SO2 气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.高铁酸钾(K2FeO4)是一种新型、高效、多功能绿色水处理剂,比Cl2、O2、ClO2、KMnO4氧化性更强,无二次污染,工业上是先制得高铁酸钠,然后在低温下,向高铁酸钠溶液中加入KOH至饱和,使高铁酸钾析出。
(1)干法制备高铁酸钠的主要反应为:2FeSO4 + 6 Na2O2 = 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑,该反应中氧化剂是________(填化学式),过氧化钠(Na2O2)中氧元素化合价为_____。(填数字)
(2)湿法制备高铁酸钾(K2FeO4)的反应体系中有六种数粒:Fe(OH)3、ClO-、OH-、FeO42-、Cl-、H2O。
①碱性条件下,氧化剂和还原剂的物质的量的比为3:2发生反应,写出并配平湿法制高铁酸钾的离子反应方程式:_________________。
②每生成1mol FeO42-转移___mol电子,若反应过程中转移了0.3mol电子,则还原产物的物质的量为_____mol。
(3)配平下面化学方程式,回答下列问题:____C +K2Cr2O7+H2SO4=K2SO4+CO2↑+Cr2(SO4)3+H2O。
①H2SO4在上述反应中表现出来的性质是(填选项编号)______。
A.氧化性 B.氧化性和酸性 C.酸性 D.还原性和酸性
②若反应中电子转移了0.8 mol,则产生的气体在标准状况下的体积为_____L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】次磷酸(H3PO2)是一种精细磷化工产品,具有较强还原性。回答下列问题:
(1)H3PO2是一元中强酸,写出其电离方程式____。
(2)H3PO2及NaH2PO2均可将溶液中的Ag+还原为银,从而可用于化学镀银。
①H3PO2中P元素的化合价为___。
② 利用H3PO2进行化学镀银反应中,氧化剂与还原剂的物质的量之比为4∶1,则氧化产物为__________(填化学式)。
③从分类来看,NaH2PO2属于______
a.正盐 b.酸式盐 c.钠盐 d.氧化物
(3)H3PO2的工业制法是:将白磷(P4)与Ba(OH)2溶液反应生成PH3气体和Ba(H2PO2)2,后者再与H2SO4反应。写出白磷与Ba(OH)2溶液反应的化学方程式_______Ba(H2PO2)2与H2SO4的离子方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A. 在NH![]() 和[Cu(NH3)4]2+中都存在配位键
和[Cu(NH3)4]2+中都存在配位键
B. H2O是极性分子,分子中O原子不处在2个H原子所连成的直线的中央
C. SO2、SO3、BF3、NCl3都是极性分子
D. 向含有0.1 mol [Co(NH3)4Cl2]Cl的水溶液中加入足量AgNO3溶液只能生成0.1 mol AgCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向浓硫酸中分别加入下列三种固体,对实验现象的分析正确的是( )
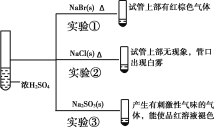
A.对比实验①和②可知还原性:Br->Cl-
B.对比实验①和③可知氧化性:Br2>SO2
C.对比实验②和③可知酸性:H2SO4>HCl>H2SO3
D.由实验可知浓硫酸具有强酸性、难挥发性、氧化性、脱水性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示土壤中甲、乙两种元素浓度变化与某植物生长速率的关系,下列分析中正确的是

A. 该植物生长对甲元素的需要大于乙元素
B. 在B浓度下施含乙元素的肥料最有利于该植物生长
C. 当该植物生长速率最大时对甲、乙元素的需要量相近
D. 持续保持甲、乙元素供应量相等将导致该植物生长不正常
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碲(Te)元素在元素周期表中位于第ⅥA族,其単质是重要的工业原料。工业上可用电解法从铜阳极泥(主要成分是Cu2Te、含Ag、Au等杂质)中提取单质碲,歩驟如下:
①将铜阳极泥在空气中焙烧使碲转化为TeO2;
②用NaOH溶液碱浸;
③以石墨为电极电解②所得溶液获得Te。
已知:TeO2微溶于水,易与较浓的强酸、强碱反应
下列说法不正确的是( )
A.Cu2Te中,Te的化合价是-2
B.歩骤②中,碱浸的子离方程式是:TeO2+2OH-=TeO32-+H2O
C.歩骤③中,阴极上发生反应的电极方程式是:TeO32-+4e-+6H+=Te+3H2O
D.在阳极区溶液中检验出有TeO42-存在,可能原因是阳极生成的氧气氧化TeO32-得到TeO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,能达到实验目的的是
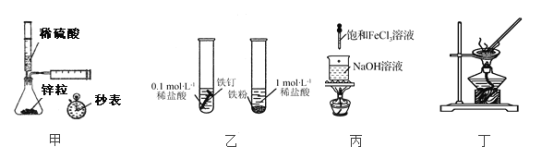
A. 用甲装置测定一定时间内产生氢气的体积,可测定该反应的速率
B. 用乙所示方法探究固体表面积对反应速率的影响
C. 用丙装置制备Fe(OH)3胶体
D. 用丁装置蒸发结晶制AlCl3晶体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com