
 ����Ӧ�úʹ������Ļ��������������������Ҫ���壮
����Ӧ�úʹ������Ļ��������������������Ҫ���壮���� ��1���ٻ�ѧƽ�ⳣ��=$\frac{������Ũ��ϵ���ݴη�}{��Ӧ��Ũ��ϵ���ݴη�}$����̬�ʹ�Һ�岻���룻a���÷�Ӧ��ֻ�������������壬���ɵİ����Ͷ�����̼���������ʵ�����ֵ���䣻
b����ѧƽ�ⳣ��ֻ���¶�Ӱ�죻
c������ƽ���������ƶ���
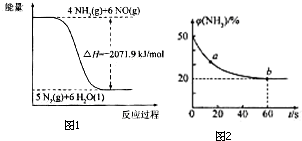
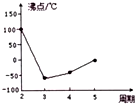
�ھ���֪�Ȼ�ѧ����ʽCO��NH2��2��s��+H2O��l��?2NH3��g��+CO2��g����H=+133.6kJ/mol����ͼ��д���Ȼ�ѧ����ʽ4NH3��g��+6NO��g��=5N2��g��+6H2O��l����H=-2071.9KJ/mol����д��
��ͼ��������������������50%�仯Ϊ20%������������ֲ��䣬˵��b�㷴Ӧ�ﵽƽ��״̬��a�㰱������ٷֺ�������b�İ�������ٷֺ�����˵����Ӧ������дﵽƽ��״̬��a�������Ӧ���ʴ���b�������Ӧ���ʣ����ݰ���������������ƽ������ʽ��ʽ����ƽ��ת���ʣ�
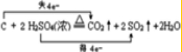
��2��9.2g NO2��Na2CO3��Һ��ȫ��Ӧʱת�Ƶ���0.1mol����ÿ2mol NO2��Na2CO3��Һ��Ӧʱת�Ƶ���1mol�������ɵ����ᣬ���ݻ��ϼ۵ı仯�ж�������Դ���д��Ӧ�����ӷ���ʽ��
��� �⣺��1�������غ�ˮ�������壬�����룬�仯ѧƽ�ⳣ��=$\frac{������Ũ��ϵ���ݴη�}{��Ӧ��Ũ��ϵ���ݴη�}$=c2��NH3��•c��CO2����
a����������ƽ����Է�������=$\frac{�������������ܺ�}{�����������ʵ����ܺ�}$���÷�Ӧ��ֻ�������������壬���ɵİ����Ͷ�����̼���������ʵ�����ֵ���䣬��a��ȷ��
b����ѧƽ�ⳣ��ֻ���¶�Ӱ�죬�¶Ȳ����䲻�䣬��b����
c���÷�Ӧ�����ȷ�Ӧ������ƽ�������ƶ�����Ӧ��ת���ʽ��ͣ���c����
�ʴ�Ϊ��c2��NH3��•c��CO2����a��
����֪��CO��NH2��2��s��+H2O��l��?2NH3��g��+CO2��g����H=+133.6kJ/mol��
��4NH3��g��+6NO��g��=5N2��g��+6H2O��l����H=-2071.9KJ/mol��
�ݸ�˹���ɣ��١�2+�ڵã�2CO��NH2��2��s��+6NO��g��=5N2��g��+2CO2��g��+4H2O��l����H=-1804.7KJ/mol��
�ʴ�Ϊ��2CO��NH2��2��s��+6NO��g��=5N2��g��+2CO2��g��+4H2O��l����H=-1804.7KJ/mol��
�۰��������������50%�仯Ϊ20%������������ֲ��䣬˵��b�㷴Ӧ�ﵽƽ��״̬��a�㰱������ٷֺ�������b�İ�������ٷֺ�����˵����Ӧ������дﵽƽ��״̬��a�������Ӧ���ʴ���b�������Ӧ���ʣ���v����CO2����v����CO2����
�谱���������ʵ���x����ʼ�����������Ϊ50%�����谱��Ϊ50mol��������̼Ϊ50mol��
CO2+2NH3?��NH2��2CO+H2O
��ʼ����mol�� 50 50 0 0
�仯����mol�� 0.5x x 0.5x 0.5x
ƽ������mol�� 50-0.5x 50-x 0.5x 0.5x
�������������=$\frac{50-x}{50-0.5x+50-x+0.5x}$=20%�����x=37.5mol��
������ƽ��ת����=$\frac{37.5mol}{50mol}$��100%=75%��
�ʴ�Ϊ������75%��
��2��9.2gNO2�����ʵ���$\frac{9.2g}{46g/mol}$=0.2mol����0.2molNO2��Na2CO3��Һ��ȫ��Ӧʱת�Ƶ���0.1mol����2molNO2��Na2CO3��Һ��Ӧʱת�Ƶ���1mol����N�Ļ��ϼ۷ֱ���+4�۱仯Ϊ+5�ۺ�+3�ۣ��ڼ�����Һ��Ӧ����NO3-��NO2-����Ӧ�����ӷ���ʽΪ��2NO2+CO32-=NO3-+NO2-+CO2�������ɵ�CO2��ȫ�ݳ���NO2-ˮ��ɼ��ԣ�������Һ�е�����Ũ�ȴ�С��ϵΪc��Na+����c��NO3-����c��NO2-����c��OH-����c��H+����
�ʴ�Ϊ��2NO2+CO32-=NO3-+NO2-+CO2��c��NO3-����c��NO2-����c��OH-����c��H+����
���� ����Ϊ�ۺ��⣬�����˸�˹�������Ȼ�ѧ����ʽ����ѧƽ����ƶ���ƽ��ļ��㣬ƽ�ⳣ���ļ��㣬��Ŀ�Ѷȴ���Ϥƽ��ԭ���ǽ���ؼ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Ũ������±�� | B�� | ��Ũ���Ṳ����ȥ | ||
| C�� | ͭ������ | D�� | ����������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
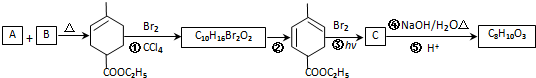
 ��RCH2CH=CH2 $��_{nv}^{Br_{2}}$ RCHBrCH=CH2
��RCH2CH=CH2 $��_{nv}^{Br_{2}}$ RCHBrCH=CH2 ��
��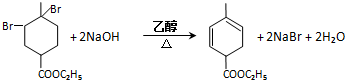 ��
�� ��2������Ӧ�ܵĻ�ѧ����ʽΪ
��2������Ӧ�ܵĻ�ѧ����ʽΪ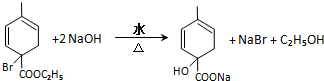 ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���³�ѹ�£�16gO2�к��е���������ΪNA | |
| B�� | 1molOH-�к��еĵ�����Ϊ10NA | |
| C�� | ��״���£�11.2LH2O�к��е���ԭ����ΪNA | |
| D�� | 1mol/LBaCl2��Һ�к��еı�������ΪNA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | C2H4��C2H20һ����Ϊͬϵ�� | |
| B�� | ������ͱ���������ˮ���ϣ���������3�ֶ��� | |
| C�� | �������������ڱ�����������ת��Ϊ������̼��ˮ�����ͷ����� | |
| D�� | ������Һ�м��뱥�ͣ�NH4��2SO4��Һ���г����������ټ�ˮ�������ܽ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
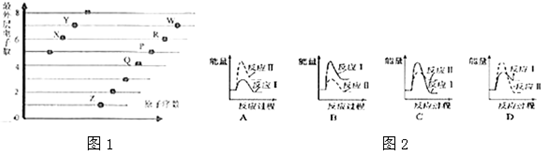
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 X��Y��Z��W��R��T��Ԫ�����ڱ�ǰ�����ڳ���Ԫ�أ���ԭ���������������������Ϣ���±���
X��Y��Z��W��R��T��Ԫ�����ڱ�ǰ�����ڳ���Ԫ�أ���ԭ���������������������Ϣ���±���| Ԫ�� | �����Ϣ |
| X | Ԫ���������������۵ľ���ֵ��� |
| Y | �ǵؿ��к�������Ԫ�� |
| Z | Ԫ�ػ�̬ԭ��3p�ܼ�ֻ��һ������ |
| W | ��Zλ��ͬ���ڣ�������ߵ�p �ܼ�����Ϊ����� |
| R | ����Ϊ��ɫ���壬�������ڻ�ɽ�緢�� |
| T | Ԫ�ػ�̬ԭ�Ӻ�δ�ɶԵ������ |
| ��һ������ | ���Ӱ뾶 | ���ӻ�ԭ�� | �����������۵� |
| W��R | Y��Z | Y��R | X��Z |
 ����
���� ����
�����鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
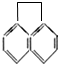 ��һ�ȴ��ﹲ�У������������칹����������
��һ�ȴ��ﹲ�У������������칹����������| A�� | 3�� | B�� | 4�� | C�� | 5 �� | D�� | 7�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �Ҵ�������������Һ�����Խ������������ﵽ������Ŀ�� | |
| B�� | ���������Һ��˫��ˮ������ԭ����ͬ | |
| C�� | ˫��ˮ���н�ǿ�ĸ�ʴ�ԣ�����������ϴ���� | |
| D�� | �ڴ���������Һ��ͨ��������������ɵõ��������ƺʹ����� |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com