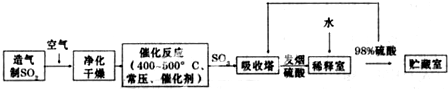
硫酸是工业生产中最为重要的产品之一,在化学工业的很多领域都要用到硫酸,如橡胶的硫化、表面活性剂“烷基苯硫酸钠”的合成,铅蓄电池的生产等.工业上生产硫酸的流程图如下:
请回答下列问题
(1)在硫酸工业生产中,我国采用黄铁矿为原料生产SO
2,已知1gFeS
2完全燃烧放出7.2kJ的热量FeS
2燃烧反应的热化学方程式
.
(2)为了有利于SO
2转化为SO
3,且能充分利用热能,采用在具有多层催化剂且又热交换的
(填仪器名称)中进行反应.在如图1所示的装置中,A处气体进入装置前需净化的原因是
.
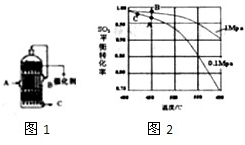
(3)精制炉气(含有SO
2体积分数为7%、O
2为11%、N
2为82%)中SO
2平衡转化率与温度及压强关系如图2所示、在实际生产中,SO
2催化氧化反应的条件选择常压、450℃左右(对应图中A点):而没有选择SO
2转化率更高的B或C点对应的反应条件,其原因分别是:
、
.
(4)已知:焙烧明矾的化学方程式4KAl(SO
4)2?12H
2O+3S═2K
2SO
4+2Al
2O
3+9SO
2+48H
2O.
焙烧711t明矾(M=474g/mol),若 SO
2的利用率为95%,可生产质量分数为98%的硫酸
t.(结果保留小数点后一位)
(5)除硫酸工业外,还有许多工业生产.下列相关的工业生产流程中正确的是
A.海水提溴:海水浓缩
溴蒸气
液溴
B.海水提镁:海滩贝壳
石灰水
MgO
镁
C.工业制硝酸:空气
NO
2硝酸→尾气处理
D.工业合成氯:天然气
氢气
NH
3、H
2、N
2氯.
(6)由吸收塔排出的尾气中有SO
2的含量如果超过500μL/L,就要加以处理后才能排出,处理方法之一是用氨水洗涤烟气脱硫,用方程式表示氨水洗涤吸收塔排除的尾气的化学方程式
.





 天天练口算系列答案
天天练口算系列答案
 为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验:
为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验: