
【题目】某兴趣小组欲测定市场上某H2O2消毒液质量分数,现进行如下操作
己知:2MnO4﹣+5H2O2+6H+═2Mn2++8H2O+5O2
操作①:取10.00mLH2O2溶液(密度为1.00gmL﹣1)置于锥形瓶中加水稀释,再加稀硫酸酸化;
操作②:用0.200 0molL﹣1KMnO4溶液滴定;
操作③:用同样方法滴定,4次消耗KMnO4溶液的体积分别为20.00mL、19.98mL、20.02mL、22.00mL.请回答下列问题:
(1)滴定时盛装KMnO4溶液应选取的仪器是(填序号).
A.50mL酸式滴定管
B.50mL碱式滴定管
C.25mL酸式滴定管
D.25mL碱式滴定管
(2)是否需要选用指示剂(填“是”或“否”)达到滴定终点的现象是 .
(3)分析数据,计算该H2O2溶液中溶质的质量分数为(保留三位有效数字).
【答案】
(1)C
(2)否,滴入最后一滴酸性KMnO4溶液,溶液由无色变为紫红色,30秒内不恢复
(3)3.40%
【解析】解:(1)KMnO4溶液具有强氧化性,可以腐蚀橡皮管,故KMnO4溶液应装在酸式滴定管中,四次消耗KMnO4溶液的体积分别为20.00mL、19.98mL、20.02mL、22.00mL,所以选用25ml酸式滴定管可以完成实验,
所以答案是:C;
(2)KMnO4溶液为紫红色溶液,可以根据高锰酸钾溶液溶液颜色变化判断滴定终点,所以不需要指示剂;该滴定终点的现象为:滴入最后一滴酸性KMnO4溶液,溶液由无色变为紫红色,30秒内不恢复,说明反应结束,
所以答案是:否; 滴入最后一滴酸性KMnO4溶液,溶液由无色变为紫红色,30秒内不恢复;
(3)过氧化氢溶液中过氧化氢质量=5.0ml×1.0g/ml=5g,用0.1000mol/L KMnO4溶液滴定,用同样方法滴定,四次消耗KMnO4溶液的体积分别为20.00mL、19.98mL、20.02mL、22.00ml,第四次误差较大舍去,平均 消耗高锰酸钾溶液体积= ![]() =20.00mL,
=20.00mL,
根据反应 | 2MnO4﹣+ | 5H2O2+6H+=2Mn2++8H2O+5O2↑ |
2 | 5 | |
0.2000mol/L×0.02L | n(H2O2) |
![]() =
= ![]() ,解得:n(H2O2)=0.01mol,
,解得:n(H2O2)=0.01mol,
则过氧化氢质量分数为: ![]() ×100%=3.40%,
×100%=3.40%,
所以答案是:3.40%.
【考点精析】解答此题的关键在于理解酸碱中和滴定的相关知识,掌握中和滴定实验时,用蒸馏水洗过的滴定管先用标准液润洗后再装标准液;先用待测液润洗后在移取液体;滴定管读数时先等一二分钟后再读数;观察锥形瓶中溶液颜色的改变时,先等半分钟颜色不变后即为滴定终点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大,W与Y、X与Z位于同一主族,W与X可形成共价化合物WX2,Y原子的内层电子总数是其最外层电子数的2.5倍。下列叙述不正确的是
A. 原子半径的大小顺序为X<W<Y<Z B. WX2、YX2和ZX2均只含共价键
C. W、X、Y、Z最外层电子数之和为20 D. Z的气态氢化物比Y的稳定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.现有三个反应:
反应①![]()
![]() =a kJ/mol平衡常数为K1
=a kJ/mol平衡常数为K1
反应②![]()
![]() 平衡常数为K2
平衡常数为K2
反应③![]()
![]() =b kJ/mol平衡常数为K3
=b kJ/mol平衡常数为K3
在不同温度下,部分K1、K2的值如下:
T/℃ | 700 | 800 |
K1 | 2.38 | 2.56 |
K2 | 0.80 |
(1) ![]()
![]() ==____________________
==____________________
(2)K1的表达式为____________;根据反应①、②、③推导出K1、K2、K3的关系式K3=______________。
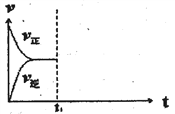
(3)在恒温恒压密闭容器中通入CO和H2O各1mol发生反应②,当反应达到平衡后,维持温度与压强不变,t1时再通入各1mol的CO和H2O的混合气体,请在下图中画出正(v正)、逆(v逆)反应速率在t1后随时间t变化的曲线图_______。
Ⅱ.在容积相同的两个密闭容器内(装有等量的某种催化剂),分别充入同量的NOx及C3H6,在不同温度下,同时发生以下反应:
18NO(g)+2C3H6(g) 9N2(g)+6CO2(g)+6H2O(g):
18NO2(g)+4C3H6(g) 9N2(g)+12CO2(g)+12H2O(g);
并分别在t秒时测定其中NOx转化率,绘得图像如下图所示:
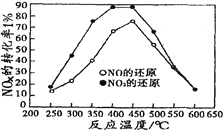
①从图中可以得出的结论是
结论一:从测定NOx转化数据中判断,相同温度下NO转化效率比NO2的低。
结论二:________________________________________________________
②在上述NO2和C3H6反应中,提高NO2转化率的措施有_____________。(填编号)
A.加入催化剂 B.降低温度 C.分离出H
Ⅲ.常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.6,c(H2CO3)=1.5×10 -5 mol/L。若忽略水的电离及H2CO3的第二级电离,则H2CO3HCO3-+ H+ 的平衡常数K1=___________。(已知:10-5.60=2.5×10-6 )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)为了验证Fe3+与Cu2+氧化性强弱,下列装置能达到实验目的的是_______。

(2)将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。
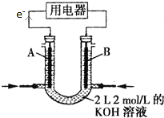
A处其电极反应式为___________;
(3)某元素的同位素![]() ,它的氯化物XCl21.11g溶于水配成溶液后,加入1mo1/L的AgNO3溶液20mL,恰好完全反应。若这种同位素的原子核内有20个中子,Z的值为_____,A的值为______。
,它的氯化物XCl21.11g溶于水配成溶液后,加入1mo1/L的AgNO3溶液20mL,恰好完全反应。若这种同位素的原子核内有20个中子,Z的值为_____,A的值为______。
(4)将固体NH4Br置于密闭容器中,在某温度下,发生下列反应:
NH4Br(s)![]() NH3(g)+HBr(g) 2HBr(g)
NH3(g)+HBr(g) 2HBr(g)![]() Br2(g)+H2(g)
Br2(g)+H2(g)
2min后,测知c(H2)=0.5mo/L,c(HBr)=4mol/L。若上述反应速率用v(NH3)表示,则v(NH3)=_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)原电池可将化学能转化为电能。若Fe、Cu和浓硝酸构成原电池,负极是_____(填“Cu”或“Fe”);若Zn、Ag和稀盐酸构成原电池,正极发生_____反应(填“氧化“或还原”)。质量相同的铜棒和锌棒用导线连接后插入CuSO4溶液中,一段时间后,取出洗净、干燥、称量,二者质量差为12.9g。则导线中通过的电子的物质的量是____mol。
(2)肼-空气碱性(KOH为电解质)燃料电池(氧化产物为大气主要成分)的能量转化率高。已知:电流效率可用单位质量的燃料提供的电子数表示。肼-空气碱性(KOH为电解质)燃料电池、氨气-空气碱性(KOH为电解质)燃料电池(氧化产物为大气主要成分)的电流效率之比为____。
(3)一定温度下,将3molA气体和1molB气体通入一容积固定为2L的密闭容器中,发生如下反应:3A(g)+B(g)![]() xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,x为_____。若反应经2min达到平衡,平衡时C的浓度____0.8mol/L(填“大于,小于或等于”)。若已知达平衡时,该容器内混合气休总压强为p,混合气体起始压强为p0。请用p0、p来表示达平衡时反应物A的转化率为________。
xC(g),反应1min时测得剩余1.8molA,C的浓度为0.4mol/L,x为_____。若反应经2min达到平衡,平衡时C的浓度____0.8mol/L(填“大于,小于或等于”)。若已知达平衡时,该容器内混合气休总压强为p,混合气体起始压强为p0。请用p0、p来表示达平衡时反应物A的转化率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于aA(g)+bB(g)cC(g)反应,改变某一变量(条件)得到如图象(p 表示压强,T 表示温度,n 表示物质的量,á 表示平衡转化率).根据图象,下列判断正确的是( )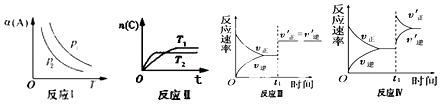
A.反应 I:若 p1>p2 , 则 a+b<c
B.反应Ⅱ:此反应的△H<0,且 T1<T2
C.反应Ⅲ:表示t1 时刻一定是使用催化剂对反应速率的影响
D.反应Ⅳ:表示t1时刻增大 B 的浓度对反应速率的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.纸篓着火用水浇灭,因为水能降低可燃物的着火点
B.小苏打治疗胃酸过多,因为小苏打能中和盐酸
C.铁粉作食品保鲜剂,因为铁粉能与氧气和水反应
D.生铁和钢的性能不同,因为生铁的含碳量比钢少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,二元弱酸H2Y溶液中滴加KOH溶液,所得混合溶液的pH与微粒浓度变化的关系如图所示,下列有关说法错误的是

A. 曲线M表示lg![]() 与pH的变化关系
与pH的变化关系
B. Ka2(H2Y)=10-4.3
C. d点溶液中:c(H+)-c(OH-)=2c(Y2-)+c(HY-)-c(K+)
D. 交点e的溶液中:c(H2Y)=c(Y2-)>c(HY-)>c(H+)>c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com