
| A. | ③⑦⑧ | B. | ②③⑦⑧ | C. | ③④⑤⑦ | D. | ④⑤⑥⑦ |
分析 二氧化硫和二氧化碳均为酸性氧化物,但二氧化硫具有还原性、氧化性、漂白性,以此来解答.
解答 解:①二氧化硫与高锰酸钾溶液发生氧化还原反应,溶液褪色,二氧化碳不能,可鉴别,故不选;
②二氧化硫与溴水发生氧化还原反应,溶液褪色,二氧化碳不能,可鉴别,故不选;
③二者均使澄清石灰水变浑浊,现象相同,不能鉴别,故选;
④二氧化硫与酸化的硝酸钡溶液反应生成白色沉淀,二氧化碳不能,可鉴别,故不选;
⑤二氧化硫与氯化铁和氯化钡混合液,有白色沉淀生成,二氧化碳不能,可鉴别,故不选
⑥二氧化硫使品红溶液褪色,二氧化碳不能,可鉴别,故不选;
⑦二者均与硅酸钠溶液反应生成白色沉淀,现象相同,不能鉴别,故选;
⑧二者均氯化钡溶液不反应,现象相同,不能鉴别,故选;
故选A.
点评 本题考查物质的鉴别,为高频考点,把握物质的性质及发生的反应和现象为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识的应用,题目难度不大.


 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源: 题型:解答题
 Ⅰ.查阅资料,乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸.
Ⅰ.查阅资料,乙二酸(HOOC-COOH,可简写为H2C2O4)俗称草酸,易溶于水,属于二元中强酸(为弱电解质),且酸性强于碳酸.| 试管A | 试管B | |
| 加入试剂 | 2mL0.1mol/L H2C2O4溶液、1mL 0.05mol/L 酸性KMnO4 | 2mL0.1mol/L H2C2O4溶液、 1mL 0.05mol/L 酸性KMnO4, 少量硫酸锰固体(填物质名称) |
| 实验现象(褪色时间) | 褪色时间10min | 褪色时间<10min (选填“<”“>”或“=”) |
| 结论 | 猜想Ⅱ正确 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
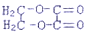 ),请根据下列转化关系图回答问题:
),请根据下列转化关系图回答问题:
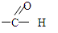 ,C的化学名称是乙二醛.
,C的化学名称是乙二醛.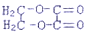 +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁粉表面的油污用热的纯碱溶液去油污效果更好 | |
| B. | 常温下,向水中加入少量固体硫酸氢钠,c(H+)增大,Kw不变 | |
| C. | 制备无水的AlCl3、FeCl3均不能采用将溶液在空气中直接蒸干的方法 | |
| D. | 室温下,向0.1mol•L-1的HF溶液中加入水溶液显碱性的物质,HF的电离程度一定增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘单质的升华过程中,只需克服分子间作用力 | |
| B. | NH4Cl属于离子化合物,该物质中不存在共价键 | |
| C. | 在N2、CO2和SiO2物质中,都存在共价键,它们都是由分子构成 | |
| D. | 金刚石和足球烯(C60)均为原子晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3、NaHSO4 | B. | CuSO4、BaCl2 | C. | AgNO3、NH3•H2O | D. | MgCl2、NaOH |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 滴定次数 | 样品的质量/g | 稀盐酸的体积/mL | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 0.3000 | 1.02 | 21.03 |
| 2 | 0.3000 | 2.00 | 21.99 |
| 3 | 0.3000 | 0.20 | 20.20 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com