
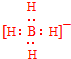 ;V的氢氧化物作弱酸时有类似TR4-的离子产生,其电离方程式为Al(OH)3+H2O?H++[Al(OH)4]-.
;V的氢氧化物作弱酸时有类似TR4-的离子产生,其电离方程式为Al(OH)3+H2O?H++[Al(OH)4]-.分析 R、T、V、X、Y分别代表原子序数依次增大的短周期主族元素,在已发现的元素里R的原子半径最小,则R为H元素;X的晶体熔点高、硬度大、有脆性,在常温下化学性质不活泼,则X为Si元素;T与Y可组成共价化合物TY3,而且Y的原子序数大于Si,V的原子序数小于Si,则V为B元素,Y为Cl元素,所以共价化合物TY3为BCl3;T、V同主族,则V为Al元素;Z元素基态原子核外M能层上p轨道与d轨道的电子总数相等,即M能层上p轨道与d轨道的电子总数都是6,所以其电子排布为1s22s22p63s23p63d64s2,为Fe元素,结合元素周期律与元素化合物性质解答.
解答 解:R、T、V、X、Y分别代表原子序数依次增大的短周期主族元素,在已发现的元素里R的原子半径最小,则R为H元素;X的晶体熔点高、硬度大、有脆性,在常温下化学性质不活泼,则X为Si元素;T与Y可组成共价化合物TY3,而且Y的原子序数大于Si,V的原子序数小于Si,则V为B元素,Y为Cl元素,所以共价化合物TY3为BCl3;T、V同主族,则V为Al元素;Z元素基态原子核外M能层上p轨道与d轨道的电子总数相等,即M能层上p轨道与d轨道的电子总数都是6,所以其电子排布为1s22s22p63s23p63d64s2,Z为Fe元素,
(1)Z为Fe元素,其原子核外有26个电子,其电子排布式为1s22s22p63s23p63d64s2,
故答案为:1s22s22p63s23p63d64s2;
(2)BCl3中B原子的价层电子对数=3+$\frac{1}{2}$(3-3×1)=3,属于sp2杂化,其分子构型为平面三角形;
故答案为:平面三角形;
(3)Si属于原子晶体、Al属于金属晶体、Cl2属于分子晶体,则熔点由高到低的排列顺序是Si>Al>Cl2;LiBH4为近年来储氢材料领域的研究热点,其中BH4-的电子式为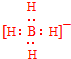 ;Al的氢氧化物作弱酸时有类似BH4-的离子产生,其电离方程式为Al(OH)3+H2O?H++[Al(OH)4]-.
;Al的氢氧化物作弱酸时有类似BH4-的离子产生,其电离方程式为Al(OH)3+H2O?H++[Al(OH)4]-.
故答案为:Si>Al>Cl2;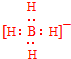 ;Al(OH)3+H2O?H++[Al(OH)4]-;
;Al(OH)3+H2O?H++[Al(OH)4]-;
(4)Cl的二氧化物为一种气体,它是新一代饮用水的消毒剂、可用NaYO3与浓盐酸反应制取,在该反应中氧化剂与还原剂的物质的量之比为1:1,其化学方程式为2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2H2O;
故答案为:2NaClO3+4HCl═2ClO2↑+Cl2↑+2NaCl+2H2O.
点评 本题考查结构性质位置关系应用,根据电子排布规律和元素在周期表中的位置推断元素是解题的关键,注意基础知识的理解掌握,难度中等,侧重于考查学生的分析能力和对基础知识的综合应用能力.


科目:高中化学 来源: 题型:多选题
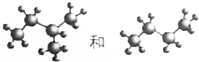
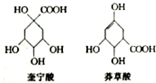 奎宁酸和莽草酸是某些高等植物特有的脂环状有机酸,常共存在一起,其结构简式如图所示.下列说法不正确的是( )
奎宁酸和莽草酸是某些高等植物特有的脂环状有机酸,常共存在一起,其结构简式如图所示.下列说法不正确的是( )| A. | 奎宁酸的相对分子质量比莽草酸的大18 | |
| B. | 可用高锰酸钾溶液鉴别奎宁酸和莽草酸 | |
| C. | 等物质的量的奎宁酸和莽草酸分别与足量Na反应,同温同压下产生H2的体积比为4:5 | |
| D. | 等物质的量的两种分别与足量NaOH溶液反应,消耗NaOH的物质的量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
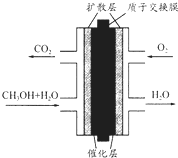 直接甲醇燃料电池(DMFC)有望取代传统电池,它主要由阴极极板、阳极极板和膜电极构成,其中膜电极包括质子膜、催化剂层和气体扩散层(如图).下列关于DMFC工作原理的叙述正确的是( )
直接甲醇燃料电池(DMFC)有望取代传统电池,它主要由阴极极板、阳极极板和膜电极构成,其中膜电极包括质子膜、催化剂层和气体扩散层(如图).下列关于DMFC工作原理的叙述正确的是( )| A. | 通入O2的电极反应式为:O2+4e-+2H2O═4OH- | |
| B. | 电池内部H+由正极渗过交换膜向负极移动 | |
| C. | 甲醇在正极发生反应,电流经过外电路流向负极 | |
| D. | 注入CH3OH的电极反应式为:CH3OH+H2O-6e-═CO2+6H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6种 | B. | 8种 | C. | 10种 | D. | 12种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
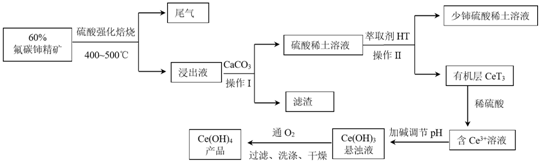
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | Al2O3、SiCl4均为共价化合物 | |
| B. | 生产过程中均涉及氧化还原反应 | |
| C. | 石英可用于制光导纤维,晶体Si常用做半导体材料 | |
| D. | 黄铜矿冶炼铜时产生的SO2可用于生产硫酸,FeO可用于冶炼铁 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
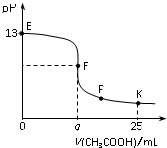 25℃时,在25 mL 0.1 mol/L的NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,混合溶液pH的变化曲线如图所示,下列分析结论正确的是( )
25℃时,在25 mL 0.1 mol/L的NaOH溶液中逐滴加入0.2mol/L CH3COOH溶液,混合溶液pH的变化曲线如图所示,下列分析结论正确的是( )| A. | a=12.5,且混合溶液pH=7 | |
| B. | 对应曲线上E、F之间的任何一点,溶液中都有c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| C. | P点时,c(CH3COO-)>c(Na+)>c(H+)=c(OH-) | |
| D. | K点时,c(CH3COO-)+c(CH3COOH)=2c(Na+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com