
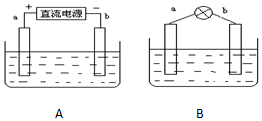
 采用如下方法制作碱性氢氧燃料电池.如图A所示:a,b均为多孔石墨棒,其电解质溶液为NaOH,由于使用多孔石墨棒,此时生成的气体中有一部分被石墨棒吸附.然后如图B所示,移走直流电源,在a,b极间连接一个小灯炮,可以看到灯泡发光.请问:
采用如下方法制作碱性氢氧燃料电池.如图A所示:a,b均为多孔石墨棒,其电解质溶液为NaOH,由于使用多孔石墨棒,此时生成的气体中有一部分被石墨棒吸附.然后如图B所示,移走直流电源,在a,b极间连接一个小灯炮,可以看到灯泡发光.请问:分析 (1)A装置图是电解池装置,依据电源的正负极分析判断电极,a为阳极;b为阴极;结合电解质溶液是强碱溶液,惰性电极电极氢氧化钠溶液实质电解水,氢氧化钠溶液浓度增大,依据离子放电写出电极反应;
(2)图B是原电池装置,依据电解过程生成气体可知,a电极生成的是氧气;b电极生成的是氢气,说明氢气和氧气再氢氧化钠溶液中形成了燃料电池,氧气一端做正极,氢气一端做负极.
解答 解:(1)A装置图是电解池装置,依据电源的正负极分析判断电极,a为阳极;b为阴极;b是水中的氢离子放电,电极反应式为:2H++2e-=H2↑,转移0.1mol电子时,b极产生的气体在标准状况下的体积为0.1×$\frac{22.4}{2}$=1.12L,故答案为:2H++2e-=H2↑;1.12L;
(2)图B是原电池装置,依据电解过程生成气体可知,a电极生成的是氧气;b电极生成的是氢气,说明氢气和氧气再氢氧化钠溶液中形成了燃料电池,氧气一端做正极,氢气一端做负极;电流方向从正极流向负极,即a→b,此时的电流方向是顺时针,a电极是正极,电极反应式为O2+2 H2O+4e-=4OH-,
故答案为:正极;O2+2 H2O+4e-=4OH-.
点评 本题考查了电解池、原电池的原理应用,电子守恒的计算应用,电极判断,电极名称,电极反应的分析判断是解题关键,题目较简单.


科目:高中化学 来源: 题型:解答题
 25℃时,电离平衡常数:
25℃时,电离平衡常数:| 弱酸的化学式 | CH3COOH | HClO | H2CO3 |
| 电离平衡常数 (25℃) | 1.8×10-5 | 3.0×10-8 | K1=4.3×10-7 K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4 种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgCl=AgI=Ag2S | B. | AgCl<AgI<Ag2S | C. | AgCl>AgI>Ag2S | D. | AgI>AgCl>Ag2S |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 大理石和稀盐酸 | B. | CaO和浓氨水 | C. | Cu和浓硝酸 | D. | MnO2和双氧水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解时在正极得到氯气,在负极得到金属钠 | |
| B. | 若在正极附近有黄绿色的气体产生 | |
| C. | 若在负极附近的溶液中滴入酚酞溶液,溶液呈无色 | |
| D. | 电解一段时间后,将电解液全部转移到烧杯中,充分搅拌后溶液呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应的氧化剂是ClO- | |
| B. | 反应生成l mol氧化产物时,转移的电子为6 mol | |
| C. | 氧化剂与还原剂的物质的量之比为2:3 | |
| D. | 反应后溶液的酸性明显增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com