
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)将水蒸气通过红热的炭即可产生水煤气。反应为:C(s)+H2O(g) CO(g)+H2 (g) △H = + 131.3 kJ • mol﹣1, △S = +133.7 J∙K﹣1•mol﹣1
CO(g)+H2 (g) △H = + 131.3 kJ • mol﹣1, △S = +133.7 J∙K﹣1•mol﹣1
①该反应能否自发进行与___________有关。
②一定温度下,在一个容积可变的密闭容器中, 发生上述反应,下列能判断该反应达到化学平衡状态的是___________(填字母)。
a.容器中的压强不变
b.1 mol H—H键断裂的同时断裂2 mol H—O键
c.v正(CO)=v逆(H2O)
d.c(CO)=c(H2)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O CO2(g)+H2 (g),得到如下三组数据:
CO2(g)+H2 (g),得到如下三组数据:
| 实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
| H2O | CO | H2 | CO | |||
| 1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
| 2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
| 3 | 900 | a | b | c | d | t |
①实验1中以v(CO2)表示的反应速率为__________。
②该反应的逆反应为__________(填”吸”或”放”)热反应。
③若使实验3达到与实验2相同的平衡状态(即各物质的质量分数分别相等),且t<3min, 则a、b应满足的关系是______________(用含a、b的数学式表示)。
(3)目前工业上有一种方法是用CO2来生产甲醇。一定条件下发生反应:
CO2(g)+3H2(g) CH3OH(g)+ H2O(g),如图表示该反应进行过程中能量(单位为kJ • mol﹣1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2 ,下列措施中能使c(CH3OH)增大的是__________。
CH3OH(g)+ H2O(g),如图表示该反应进行过程中能量(单位为kJ • mol﹣1)的变化。在体积为1 L的恒容密闭容器中,充入1 mol CO2和3 mol H2 ,下列措施中能使c(CH3OH)增大的是__________。
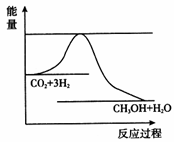
a.升高温度
b.充入He(g),使体系压强增大
c.将H2O(g)从体系中分离出来
d.再充入1 mol CO2和3 mol H2
【答案】(1)①温度 ②bc (2)①0.16 mol • L﹣1 • min﹣1 ②吸 ③b=2a且a>1(或使用合适的催化剂) (3)cd
【解析】(1)一个反应能否自发进行,可以根据△H-T△S的数值大小来判断,反应是否达到平衡,判断的标志是v(正)=v(逆), 或间接判断v(正)=v(逆),该反应为压强前后不变的反应,不能根据压强来判断反应是否达到平衡,H—H键断裂和H—O 键断裂分别为v(正)和v(逆),且相等,同理v正(CO)= v逆(H2O)也可判断v(正)和v(逆),可以作为反应达到平衡的标志。(2)实验2物质的起始量为实验1的一半,若不改变温度,达到平衡后,实验2中物质的平衡量应该也为实验1的一半,升高温度,物质的平衡量小于实验1的一半,说明反应向逆向进行,逆反应为吸热反应。要使实验3达到与实验2相同的平衡状态(即各物质的质量分数分别相等),两者为等效平衡状态,则起始物质的物质的量之比相等,即b=2a,达到平衡所需时间t<3min,首先考虑使用催化剂,再就是增大起始物质的物质的量,即增大反应物的浓度,加快反应速率。(3)从反应能量图可知,该反应的正反应为放热反应,升髙温度,平衡向逆向进行,c(CH3OH)减小;充入He(g),使体系压强增大,但反应体系的各物质分压不变,对平衡无影响;将H2O(g)从体系中分离出来,平衡正向移动,c(CH3OH)增大;再充入1 mol CO2和3 mol H2 ,达到平衡后c(CH3OH)要大于原先的2倍。


科目:高中化学 来源: 题型:
下列过程或现象与盐类水解无关的是( )
|
| A. | 热的Na2CO3溶液可以除去油污 |
|
| B. | ZnCl2和NH4Cl溶液可作金属焊接中的除锈剂 |
|
| C. | 用食醋除水垢 |
|
| D. | 将AlCl3溶液加热蒸干、灼烧,最后得到的固体时Al2O3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D、E五种溶液分别是NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:
①将1L pH=3的A溶液分别与0.001mol/L x L B溶液、0.001mol/L y L D溶液充分反应至中性,x、y的大小关系式y<x;
②浓度均为0.1mol/L A和E溶液,pH:A<E
③浓度均为0.1mol/L C和D溶液等体积混合,溶液呈酸性.
回答下列问题:
(1)C是 溶液,D是 溶液.
(2)用水稀释0.1mol/L B溶液时,溶液中随水量的增加而减小的是 .
A.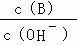 B.
B.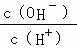 C.c (H+)•c (OH﹣) D.n (OH﹣)
C.c (H+)•c (OH﹣) D.n (OH﹣)
(3)等pH、等体积的两份溶液A和E,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出的氢气的质量相同.则 (填化学式)溶液中锌粉有剩余.
(4)常温下,向0.01mol/L C溶液中滴加0.01mol/L D溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为 .
(5)已知常温下Mg(OH)2在pH=12的D溶液中Mg2+的浓度为1.8×10﹣7mol/L,则 Ksp[Mg(OH)2]= .
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,甲池的总反应式O2+N2H4 2H2O+N2。有关该装置工作时,说法正确的是
2H2O+N2。有关该装置工作时,说法正确的是
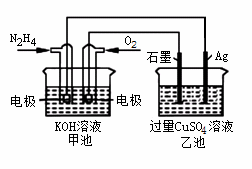
A.甲池中,负极反应为N2H4-4e-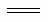 4H++N2
4H++N2
B.甲池溶液pH保持不变,乙池溶液pH减小
C.甲池中消耗2.24LO2,此时乙池中理论上最多产生12.8g固体
D.反应一段时间后,向乙池中加一定量CuO固体,能使CuSO4溶液恢复到原浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关反应的离子方程式的书写中,正确的是
A.C12通入水中:C12+H2O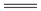 2H++Cl-+ClO-
2H++Cl-+ClO-
B.硫酸铝溶液与过量氨水反应:Al3++3NH3·H2O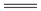 3
3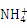 +Al(OH)3↓
+Al(OH)3↓
C.实验室用石灰石和盐酸反应制取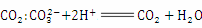
D.向Na2SO3溶液中加入稀硝酸:
查看答案和解析>>
科目:高中化学 来源: 题型:
在硫酸铁电化浸出黄铜矿精矿工艺中,有一主要反应:CuFeS2+4Fe3+=Cu2++5Fe2++2S,反应结束后,经处理获得单质硫x mol。下列说法正确的是
A.反应中硫元素被氧化,所有铁元素均被还原
B.氧化剂是Fe3+,氧化产物是Cu2+
C.反应中转移电子的物质的量为x mol
D.反应结束后,测得溶液中三种金属离子的总物质的量为y mol,则原Fe3+的总物质的量为(y-x)mol
查看答案和解析>>
科目:高中化学 来源: 题型:
以下有关溶液(均在常温下)的结论正确的是( )
|
| A. | pH=1的盐酸与pH=5的盐酸等体积混合后pH=3 |
|
| B. | 0.1mol/L醋酸溶液100 mL与0.2 mol/L氨水50 mL混合后能恰好完全中和 |
|
| C. | pH>7的溶液中不可能存在CH3COOH分子 |
|
| D. | 等浓度等体积的KOH溶液和CH3COOH溶液混合后:c(CH3COO﹣)=c(K+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
前不久,各大媒体在显著的位置刊登了关于900t致癌大米的报道,主要是变质大米中存在的黄曲霉素使人体中的特殊基因发生突变,有转变成肝癌的可能性.它的结构如图.和1mol该化合物起反应的H2或NaOH的最大值分别是( )
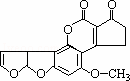
|
| A. | 6mol,2mol | B. | 7mol,2mol | C. | 6mol,1mol | D. | 7mol,1mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com