
【题目】硫、锌及其化合物用途非常广泛。回答下列问题:
(1)O和S处于同一主族。H2O及H2S中,中心原子的杂化方式相同,键长及键角如图所示。
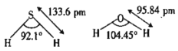
①H2O分子中的键长比H2S中的键长短,其原因是________。
②H2O分子中的键角∠HOH比H2S分子中的键角∠HSH大,其原因是________。
(2)单质硫与热的NaOH浓溶液反应的产物之一为Na2S3。S32-的空间构型为______,中心原子的杂化方式为_______。
(3)噻吩(![]() )广泛应用于合成医药、农药、染料工业。
)广泛应用于合成医药、农药、染料工业。
①噻吩分子中含有______个σ键。
②分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() ),则噻吩分子中的大π键应表示为________。
),则噻吩分子中的大π键应表示为________。
③噻吩的沸点为84℃,吡咯(![]() )的沸点在129~131℃之间,后者沸点较高,其原因是_________。
)的沸点在129~131℃之间,后者沸点较高,其原因是_________。
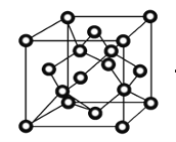
(4)冰晶体的结构与金刚石的结构相似,属立方晶系。如图,将金刚石晶胞中的C原子全部置换成O原子,O原子与最近距离的四个O原子相连,H原子插入两个相连的O原子之间,与氧形成一个共价键和一个氢键,即为冰中的共价键和氢键。0℃时冰晶体中氢键的键长(定义氢键的键长为O—H…O的长度)为_____cm(列出计算式即可)。(0℃时冰密度为0.9g/cm3。)
【答案】原子半径:O< S,故H-O键的键长较短 O的半径小于S,成键电子对间距小,斥力大,键角变大,故H2O分子中的键角更大 V形 sp3 9 ![]() 吡咯分子间可形成氢键,而噻吩分子间不能形成氢键
吡咯分子间可形成氢键,而噻吩分子间不能形成氢键 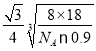
【解析】
(1)①从形成共价键的原子半径大小比较共价键的键长;
②从原子半径大小及成键电子对间的斥力大小影响分析;
(2)单质硫与热的NaOH 浓溶液反应的产物之一为Na2S3,S32-属多硫链的一种,S32-的空间构型为V形,S原子均为sp3杂化;
(3)①单键为σ键,双键中一根为σ键,一根为π键,噻吩(![]() )分子为平面结构,S原子价电子排布式为3s23p4,形成两根共价键后,S的pz轨道中一对电子与环上的π电子共轭,形成离域大π键,噻吩的芳香性仅比苯弱一点,据此分析;
)分子为平面结构,S原子价电子排布式为3s23p4,形成两根共价键后,S的pz轨道中一对电子与环上的π电子共轭,形成离域大π键,噻吩的芳香性仅比苯弱一点,据此分析;
②噻吩的沸点为84℃,吡咯(![]() )的沸点在129~131℃之间,后者沸点较高,吡咯环中存在N,N的电负性较S大,考虑形成分子间氢键使沸点升高;
)的沸点在129~131℃之间,后者沸点较高,吡咯环中存在N,N的电负性较S大,考虑形成分子间氢键使沸点升高;
(5)用均摊方法计算晶体中一个晶胞中含有的H2O分子数,可计算出晶胞的质量,结合晶体的密度公式,可得晶胞参数,再分析晶胞中最近的两个O原子的距离为晶胞体对角线的![]() 计算。
计算。
(1)①由于原子半径O<S,所以H2O分子中的H-O键长比H2S中的H-S键长短;
②H2O分子和H2S分子都是V形分子,但由于O原子的半径小于S原子半径,成键电子对间距小,斥力大,使键角变大,故H2O分子中的键角更大;
(2)单质硫与热的NaOH 浓溶液反应的产物之一为Na2S3,S32-属多硫链的一种,S32-的空间构型为V形,S原子均为sp3杂化;
(3)①单键为σ键,双键中一个为σ键,一个为π键,噻吩为![]() :,则1个噻吩分子中含σ键有5+4=9个;噻吩分子为平面结构,S原子价电子排布式为3s23p4,形成两个共价键,环中存在两根π键,为单双建交替,pz轨道交盖可形成离域大π键,S的pz轨道中一对电子与环上的π电子共轭,形成离域大π键,噻吩的芳香性仅比苯弱一点,符合休克尔规则,形成五中心六电子的离域大π键,记为
:,则1个噻吩分子中含σ键有5+4=9个;噻吩分子为平面结构,S原子价电子排布式为3s23p4,形成两个共价键,环中存在两根π键,为单双建交替,pz轨道交盖可形成离域大π键,S的pz轨道中一对电子与环上的π电子共轭,形成离域大π键,噻吩的芳香性仅比苯弱一点,符合休克尔规则,形成五中心六电子的离域大π键,记为![]() ;
;
②噻吩的沸点为84℃,吡咯(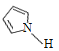 )的沸点在129~131℃之间,后者沸点较高,吡咯环中存在N,N的电负性较S大,吡咯能形成分子间氢键使沸点升高,而噻吩分子间不能形成氢键;
)的沸点在129~131℃之间,后者沸点较高,吡咯环中存在N,N的电负性较S大,吡咯能形成分子间氢键使沸点升高,而噻吩分子间不能形成氢键;
(5)在一个晶胞中含有水分子数目为![]() ×8+
×8+![]() ×6+4=8,晶胞的质量为m=
×6+4=8,晶胞的质量为m=![]() ,然后根据ρ=
,然后根据ρ=![]() 计算出晶胞参数L=
计算出晶胞参数L=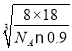 cm,晶胞体对角线长度为
cm,晶胞体对角线长度为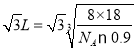 span>cm,由于两个最近的O原子之间的距离为晶胞体对角线的
span>cm,由于两个最近的O原子之间的距离为晶胞体对角线的![]() ,所以两个最近的O原子之间的距离a=
,所以两个最近的O原子之间的距离a=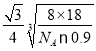 cm。
cm。


科目:高中化学 来源: 题型:
【题目】利用CO和H2在催化剂的作用下合成甲醇,发生的反应如下:CO(g)+2H2(g)![]() CH3OH(g),在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是
CH3OH(g),在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图所示。下列说法正确的是

A. 该反应的△H<0,且p1<p2
B. 反应速率:ν逆(状态A)>ν逆(状态B)
C. 在C点时,CO转化率为75%
D. 在恒温恒压条件下向密闭容器中充入不同量的CH3OH,达平衡时CH3OH的体积分数也不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中正确的是( )
A. CS2 为空间构型为V形的极性分子
B. 双原子或多原子形成的气体单质中,一定有σ键,可能有π键
C. 氢原子电子云的一个小黑点表示一个电子
D. HCN、SiF4和SO32﹣ 的中心原子均为sp3杂化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. SiO2硬度大的原因与Si、O原子之间的成键方式及排列方式有关
B. 乙醇沸点高于二甲醚的原因与分子间作用力大小有关
C. 冰醋酸溶于水时只破坏分子间作用力
D. MgO熔点高达![]() 是因为其中的离子键较难被破坏
是因为其中的离子键较难被破坏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E代表前四周期原子序数依次增大的五种元素。A、D同主族且A原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反;工业上电解熔融C2A3制取单质C;B、E除最外层均只有2个电子外,其余各层全充满。回答下列问题:
(1)B、C中第一电离能较大的是__ (用元素符号填空),基态E原子价电子的轨道表达式______。
(2)DA2分子的VSEPR模型是_____。
(3)实验测得C与氯元素形成化合物的实际组成为C2Cl6,其球棍模型如图所示。已知C2Cl6在加热时易升华,与过量的NaOH溶液反应可生成Na[C(OH)4]。
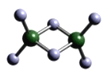
①C2Cl6属于_______晶体(填晶体类型),其中C原子的杂化轨道类型为________杂化。
②[C(OH)4]-中存在的化学键有________。
a.离子键 b.共价键 c.σ键 d.π键 e.配位键 f.氢键
(4)B、C的氟化物晶格能分别是2957 kJ/mol 、5492 kJ/mol,二者相差很大的原因________。
(5)D与E形成化合物晶体的晶胞如下图所示:
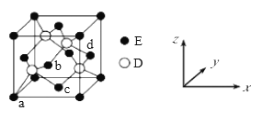
①在该晶胞中,E的配位数为_________。
②原子坐标参数可表示晶胞内部各原子的相对位置。上图晶胞中,原子的坐标参数为:a(0,0,0);b(![]() ,0,
,0,![]() );c(
);c(![]() ,
,![]() ,0)。则d原子的坐标参数为______。
,0)。则d原子的坐标参数为______。
③已知该晶胞的边长为x cm,则该晶胞的密度为ρ=_______g/cm3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为研究铁质材料与热浓硫酸的反应,某学习小组用碳素钢(即铁和碳的合金)进行了以下探究活动:
(探究一)(1)常温下,工业上用铁质容器盛放冷的浓硫酸,其原因是__________。
(2)称取碳素钢6.0g放入15.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到混合气体Y。
①甲同学认为X中除Fe3+之外还可能含有Fe2+。若要确认其中的Fe2+,应选用__________(选填序号)。
a.KSCN溶液和氯水 b.铁粉和KSCN溶液 c.浓氨水 d.酸性KMnO4溶液
②乙同学取560mL(标准状况)气体Y通入足量溴水中,然后加入足量BaCl2溶液,经适当操作后得干燥固体4.66g,由此可求算气体Y中SO2的体积分数__________。
(探究二)
根据上述实验中SO2体积分数的分析,丙同学认为气体Y中还可能含有Q1和Q2两种气体,其中Q1气体,在标准状况下,密度为0.0893gL-1。为此设计了下列探究实验装置(图中夹持仪器省略,假设有关气体完全反应)。

(3)装置B中试剂的作用是__________。
(4)分析Y气体中的Q2气体是如何生成的__________。(用化学方程式表示)。
(5)为确认Q2的存在,需在装置中添加洗气瓶M于__________(选填序号)。
a.A之前 b.A﹣B间 c.B﹣C间 d.C﹣D间
(6)如果气体Y中含有Q1,预计实验现象应是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是周期表中的一部分,根据A-I在周期表中的位置,请按要求回答下列问题:
周期 族 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
一 | A | |||||||
二 | D | E | G | I | ||||
三 | B | C | F | H |
(1)A-I中元素,化学性质最不活泼的是__________(用元素符号),还原性最强的单质是__________(用元素符号);
(2)A-I中最高价氧化物的水化物酸性最强的酸是__________(用化学式);
(3)用电子式表示D元素最高价氧化物的形成过程span>__________;
(4)写出B与C两元素最高价氧化物的水化物之间反应的离子方程式__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)写出乙烯分子的电子式:___________。
(2)写出(2-甲基-1,3-丁二烯)的结构简式_________。
(3)立方烷![]() 的一氯代物有_________种,它的六氯代物有_________种。
的一氯代物有_________种,它的六氯代物有_________种。
(4)下列物质的沸点按由高到低的顺序排列正确的是___________。
①CH3(CH2)2CH3 ②CH3(CH2)3CH3 ③(CH3)3CH ④(CH3)2CHCH2CH3
A.②④①③ B.④②①③ C.④③②① D.②④③①
(5)下列选项中互为同系物的是_________;互为同分异构体的是______________;属于同种物质的是_____________。
①H2O和D2O ②1H、2H、3H ③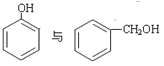 ④.
④.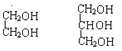 ⑤
⑤![]() ⑥戊烯和环戊烷 ⑦
⑥戊烯和环戊烷 ⑦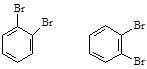
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com