
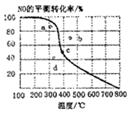
 如图中曲线为一定压强下NO的平衡转化率与温度的关系,图中a、b、c、d四点表示不同温度、压强下2NO(g)+O2(g)?2NO2(g)达到平衡时NO的转化率,则压强最大的点为( )
如图中曲线为一定压强下NO的平衡转化率与温度的关系,图中a、b、c、d四点表示不同温度、压强下2NO(g)+O2(g)?2NO2(g)达到平衡时NO的转化率,则压强最大的点为( )| A. | a | B. | b | C. | c | D. | d |
科目:高中化学 来源: 题型:选择题
| A. | 溶解、过滤、蒸发 | B. | 溶解、过滤、洗涤、干燥 | ||
| C. | 溶解、过滤、结晶 | D. | 溶解、结晶、干燥 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
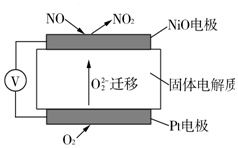
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 金属(粉末状)(mol) | 酸的浓度及体积 | 反应温度(℃) | ||
| A | Al | 0.1 | 0.1mol•L-1 硫酸 | 10mL | 60 |
| B | Fe | 0.1 | 0.2mol•L-1盐酸 | 10mL | 60 |
| C | Al | 0.1 | 18mol•L-1 硫酸 | 10mL | 60 |
| D | Mg | 0.1 | 0.2mol•L-1 硝酸 | 10mL | 60 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
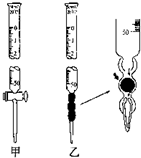 某学习小组用0.80mol/L标准浓度的烧碱溶液测定未知浓度的盐酸.
某学习小组用0.80mol/L标准浓度的烧碱溶液测定未知浓度的盐酸.| 实验编号 | 待测HCl溶液的体积/mL | 滴入NaOH溶液的体积/mL |
| 1 | 20.00 | 22.00 |
| 2 | 20.00 | 22.10 |
| 3 | 20.00 | 21.90 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | NaOH溶液的浓度(mol•L-1) | 滴定完成时,NaOH溶液滴入的体积(mL) | 待测盐酸的体积(mL) |
| 1 | 0.10 | 22.62 | 20.00 |
| 2 | 0.10 | 22.72 | 20.00 |
| 3 | 0.10 | 22.80 | 20.00 |
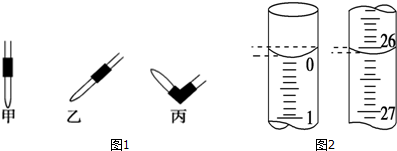
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
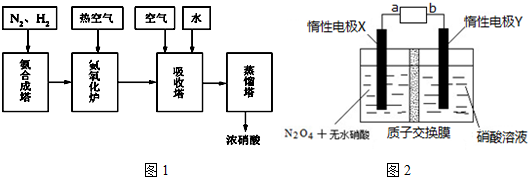
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4HCO3溶于过量的浓KOH溶液中:NH4++HCO3-+2OH-═CO32-+NH3↑+2H2O | |
| B. | 碳酸钠溶液中加入澄清石灰水:Ca(OH)2+CO32-═CaCO3↓+2OH- | |
| C. | 稀硫酸中加入铁粉:2Fe+6H+═2Fe3++3H2↑ | |
| D. | 醋酸除去水垢:2H++CaCO3═Ca2++CO2↑+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com