
【题目】如图是原电池和电解池的组合装置图。请回答:

(1)若甲池某溶液为稀H2SO4,闭合K时,电流表指针发生偏转,电极材料A为碳棒,B为Fe,则:
①A碳电极上发生的现象为___。
②丙池中E、F电极均为碳棒,E电极为__(填“正极”、“负极”、“阴极”或“阳极”)。如何检验F侧出口的产物____。
(2)若需将反应:Cu+2Fe3+=Cu2++2Fe2+设计成如图所示甲池的单液原电池装置,则正极反应式为___。
(3)若甲池为氢氧燃料电池,某溶液为KOH溶液,A极通入氢气,
①A电极的反应方程式为:___。②若线路中转移0.02mol电子,则乙池中C极质量改变___g。
【答案】产生大量无色气泡 阴极 F出口置一湿润的淀粉碘化钾试纸,淀粉变蓝,则产物为Cl2 Fe3++e=Fe2+ H2-2e+2OH=2H2O 2.16g
【解析】
(1)若甲池某溶液为稀H2SO4,闭合K时,电流表指针发生偏转,电极材料A为碳棒、B为Fe,Fe易失电子作负极,则A为正极;
①A碳电极上氢离子得电子生成氢气;
②丙池中E、F电极均为碳棒,E连接原电池负极,则E为阴极,F为阳极,F电极上氯离子放电生成氯气,氯气能使湿润的淀粉KI试纸变蓝色;
(2)若需将反应:Cu+2Fe3+═Cu2++2Fe2+设计成如上图所示的甲池的单液原电池装置,
该原电池中Cu失电子作负极,不如Cu活泼的金属或导电的非金属作正极,正极上铁离子得电子生成亚铁离子;
(3)若甲池为氢氧燃料电池,某溶液为KOH溶液,A极通入氢气,通入燃料的电极为负极,则A为负极、B为正极,正极上通入氧气;
①A电极氢气失电子和氢氧根离子反应生成水;
②若线路中转移0.02mol电子,乙池中C极为阳极,该电极上电极反应式为Ag-e-=Ag+,串联电路中转移电子相等,根据转移电子和Ag之间的关系式计算。
(1)若甲池某溶液为稀H2SO4,闭合K时,电流表指针发生偏转,电极材料A为碳棒、B为Fe,Fe易失电子作负极,则A为正极;
①A碳电极上氢离子得电子生成氢气,看到的现象是产生大量无色气泡;
②丙池中E、F电极均为碳棒,E连接原电池负极,则E为阴极,F为阳极,F电极上氯离子放电生成氯气,氯气能使湿润的淀粉KI试纸变蓝色,其检验方法为:F出口置一湿润的淀粉碘化钾试纸,淀粉变蓝,则产物为Cl2;
(2)若需将反应:Cu+2Fe3+═Cu2++2Fe2+设计成如上图所示的甲池的单液原电池装置,该原电池中Cu失电子作负极,不如Cu活泼的金属或导电的非金属作正极,正极上铁离子得电子生成亚铁离子,电极反应式为Fe3++e-═Fe2+;
(3)若甲池为氢氧燃料电池,某溶液为KOH溶液,A极通入氢气,通入燃料的电极为负极,则A为负极、B为正极,正极上通入氧气;
①A电极氢气失电子和氢氧根离子反应生成水,电极反应式为H2-2e-+2OH-═2H2O;
②若线路中转移0.02mol电子,乙池中C极为阳极,该电极上电极反应式为Ag-e-=Ag+,串联电路中转移电子相等,根据转移电子和Ag之间的关系式得m(Ag)=![]() ×108g/mol=2.16g。
×108g/mol=2.16g。


科目:高中化学 来源: 题型:
【题目】一定条件下,可逆反应N2 +3H2![]() 2NH3 △H<0,达到平衡后,当单独改变下述条件时,有关叙述错误的是
2NH3 △H<0,达到平衡后,当单独改变下述条件时,有关叙述错误的是
A.加催化剂,υ正、υ逆都发生变化,且变化的倍数相等
B.加压,υ正、υ逆都增大,且υ正增大的倍数大于υ逆增大的倍数
C.降温,υ正、υ逆都减小,且υ正减小的倍数小于υ逆减小的倍数
D.增大氮气的浓度,υ正、υ逆都增大,且υ正增大倍数大于υ逆增大倍数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组为了探究铝电极在电池中的作用,设计并进行了以下一系列实验,实验结果记录如下表:
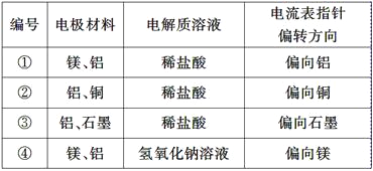
试根据表中的实验现象完成下列问题:
(1)实验①、②中铝所作的电极(指正极或负极)________(填“相同”或“不相同”)。
(2)实验③中铝为________极,电极反应式为_________________________________________;石墨为________极,电极反应式为______________;电池总反应式为____________________。
(3)实验④中铝作负极还是正极?____________,理由是_________________________,铝电极的电极反应式为__________________________________________________________。
(4)根据实验结果总结出影响铝在原电池中作正极或负极的因素为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴化钙可用作阻燃剂、制冷剂,具有易溶于水、易吸潮等性质。实验室用工业大理石(含少量Al3+、Fe3+等杂质)制备溴化钙的主要流程如下(已知步骤Ⅲ的滤液中不含![]() )。
)。
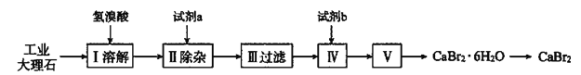
下列说法错误的是( )
A.试剂a可以是生石灰,试剂b是氢溴酸
B.步骤V所含的操作依次是蒸发浓缩、冷却结晶、过滤、洗涤、干燥
C.为将杂质离子除尽,步骤Ⅱ需加过量试剂a,保证溶液呈强碱性
D.工业上常用氨气与溴、石灰乳反应制取溴化钙,若反应中氧化剂与还原剂的物质的量比为3∶2,则产物中会生成一种无色气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法中正确的是( )
A.0.2 mol氧原子中含1.6NA个电子
B.1 mol 氯化镁中含有离子数为NA
C.12.4 g白磷中含有磷原子数为0.1NA
D.28 g一氧化碳气体所含的电子数为20NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷、砷、硫、氯等元素在生产生活和药物合成中用途广泛。回答下列问题:
(1)瑞德西韦是一种抗病毒药物,结构如下。

该结构中N、O、P原子的电负性由大到小的顺序为____________。该药物的分子间作用力有____________。
(2)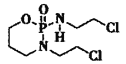 (异环磷酰胺)常用作抗癌药,1mol该物质含
(异环磷酰胺)常用作抗癌药,1mol该物质含![]() 键数目为______NA。
键数目为______NA。
(3)实验测得![]() 中Mn,C,N三种原子不在同一水平线上。则此配合物中配位原子为______,其杂化方式为______。
中Mn,C,N三种原子不在同一水平线上。则此配合物中配位原子为______,其杂化方式为______。
(4)![]() 可用作杀虫剂,其中所含As元素基态原子的价电子排布式为____________,
可用作杀虫剂,其中所含As元素基态原子的价电子排布式为____________,![]() 的空间构型为____________。
的空间构型为____________。
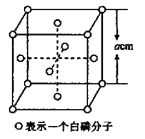
(5)白磷(P4)的晶体属于分子晶体,其晶胞结构如图所示,已知晶胞参数为acm,阿伏加德罗常数的值为NA,该晶胞中含有的P原子个数为____________,该晶体的密度为![]() ,晶体中白磷分子之间的最短距离为____________cm(用含
,晶体中白磷分子之间的最短距离为____________cm(用含![]() 、NA的式子表示)。
、NA的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Fe3O4是一种复杂的化合物,其化学式可改写为FeO·Fe2O3。对于Fe与水蒸气反应后的黑色物质,有三个学习小组提出了三种不同的猜想,以下是小组同学进行的实验猜想与探究,请你根据小组的思路与提示完成相关空白。
实验之前查阅资料得知Fe3+的盐溶液遇到KSCN溶液时,溶液变成红色,而Fe2+遇KSCN溶液无明显变化。
[猜想]甲组:黑色物质是FeO
乙组:黑色物质是Fe3O4
丙组:____________;
[实验探究]
(1)丙组认为一种简单定性的方法即可判断甲组的正误:取生成的黑色物质少许于烧杯中,加稀盐酸使其完全溶解,再加________溶液以检验Fe3+,观察到溶液有无出现________现象即可判断。
(2)乙组认为可通过定量测定来确定生成的黑色物质的组成,以验证该组猜想正确。取生成的黑色物质2.32 g溶解于适量稀盐酸后,加入新制氯水,加入氯水后反应的离子方程式为__________,再加入足量NaOH溶液后,过滤、洗涤、烘干、灼烧、称量,若称得固体质量为________,即可判断乙组同学猜想正确。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中Cl-的物质的量浓度最大的是
A. 150 mL1 mol/L NaCl溶液 B. 50 mL2mol/L NH4Cl溶液
C. 150 mL 0.5 mol/L CaCl2溶液 D. 50 mL l mol/L AlCl3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有未知浓度的盐酸25 mL,能跟20 mL某浓度的氢氧化钠溶液完全反应。若先用0.1 g 碳酸钙与25 mL这种酸作用,剩余的酸需用上述氢氧化钠溶液4 mL才能中和。求盐酸和氢氧化钠溶液中溶质的物质的量浓度分别是多少?______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com