
| A. | 氢氧化铝 | B. | 碳酸氢钠 | C. | 阿司匹林 | D. | 麻黄碱 |
分析 胃药的成分是能跟盐酸起反应的物质,以减少胃中盐酸的含量,那么可以推测胃药的主要成分应该是碱性的物质,NaHCO3水溶液呈微碱性,但与盐酸反应会放出二氧化碳加重病情.
解答 解:A.Al(OH)3对胃酸的分泌无直接影响,对胃内已存在的胃酸起中和或缓冲的化学反应,从而使胃酸过多的症状得以缓解,故A正确;
B.NaHCO3是一种盐,但水溶液呈微碱性,与盐酸反应生成二氧化碳气体,造成病情加重,故B错误;
C.阿司匹林是解热镇痛药,故C错误;
D.麻黄碱是从中药麻黄中提取的一种生物碱,具有镇咳平喘、扩张气管和缓和鼻粘膜充血等作用,用于治疗感冒、咳嗽,哮喘等常见疾病,故D错误.
故选A.
点评 本题以医药上常用的治疗胃病的药物为情境,考查了酸的化学性质及抗酸药,将化学与医药联系在一起,达到学以致用的目的.


科目:高中化学 来源: 题型:填空题
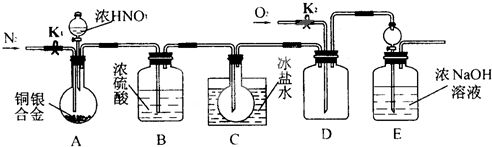
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe-3e-=Fe3+ | B. | 2Fe+2H2O+O2=2Fe(OH)2↓ | ||
| C. | 2H2O+O2+4e-=4OH- | D. | 4Fe(OH)2+2H2O+O2=4Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
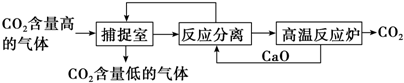
| A. | ①② | B. | ①③ | C. | ②③ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 熔点/℃ | 沸点/℃ | 化学性质 |
| Sn | 231 | 227 | 加热时与Cl2反应生成SnCl4 |
| SnCl2 | 246 | 652 | Sn2+易被Fe3+、O2等氧化 |
| SnCl4 | -33 | 114 | 极易水解 |
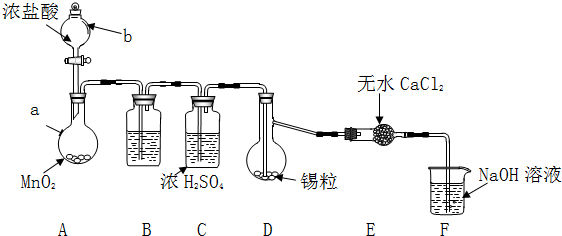
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH,KOH,CsOH碱性依次减弱 | B. | HCl,PH3,H2S稳定性依次减弱 | ||
| C. | Na,Mg,Al还原性依次减弱 | D. | S2-,Cl-,Ca2+半径依次增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com