
分析 (1)依据配制溶液的一般步骤选择需要的仪器;
(2)依据m=CVM计算需要溶质的质量;
(3)用固体配制一定物质的量浓度溶液一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶等,据此排序;
(4)分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析.
解答 解:(1)用固体配制一定物质的量浓度溶液一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等,用到的仪器:托盘天平、药匙、玻璃棒、烧杯、容量瓶、胶头滴管,配制100mL 2mol/L的KCl溶液应选择100mL容量瓶,不需要的仪器:量筒、50mL容量瓶;
故答案为:CF;
(2)配制100mL 2mol/L的KCl溶液,需要溶质的质量m=2mol/L×0.1L×74.5g/mol=14.9g;
故答案为:14.9;
(3)用固体配制一定物质的量浓度溶液一般步骤:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶等,所以正确的操作顺序为:②①③⑤⑥⑦④⑧;
故答案为:②①③⑤⑥⑦④⑧;
(4)若容量瓶未干燥即用来配制溶液,对溶质的物质的量和溶液体积都不产生影响,溶液浓度无影响;
若定容时俯视刻度线,导致溶液体积偏小,溶液浓度偏高;
故答案为:无影响;偏高.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理及操作步骤是解题关键,注意分析操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析的方法,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
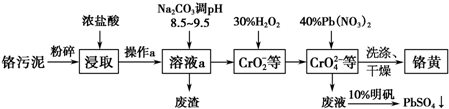
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
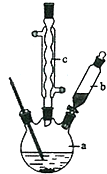 苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线:
苯乙酸铜是合成优良催化剂、传感材料--纳米氧化铜的重要前驱体之一.下面是它的一种实验室合成路线: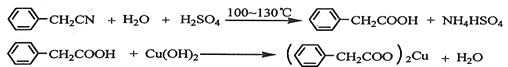
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ②③④ | C. | ①③④⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡后CO的体积分数为40% | |
| B. | 平衡后CO的转化率为25% | |
| C. | 平衡后水的转化率为50% | |
| D. | 平衡后混合气体的平均相对分子质量为24 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、C1-、Mg2+、SO42- | B. | A13+、Cu2+、SO42-、C1- | ||
| C. | Ba2+、K+、NO3-、OH- | D. | Ca2+、Na+、C1-、A1O2- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤ | B. | ①④⑤ | C. | ②③④ | D. | ②④⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com