
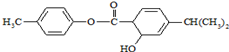
| A. | M中不含手性碳原子 | |
| B. | M中所有碳原子均可能在同一平面 | |
| C. | M可以发生加成、取代、消去等反应 | |
| D. | 1mol M常温下最多可以与3molNaOH反应 |
分析 由结构可知,分子中含-COOC-、-OH、碳碳双键,结合酯、醇、烯烃的性质来解答.
解答 解:A.与-OH相连的C连接4个不同基团,为手性碳原子,故A错误;
B.与-OH相连C、-CH(CH3)2中C均为四面体构型,所有C原子不可能共面,故B错误;
C.含碳碳双键可发生加成反应、含-COOC-可发生取代反应,含-OH可发生取代、消去反应,故C正确;
D.-COOC-及水解生成的酚-OH与NaOH反应,则1mol M常温下最多可以与2molNaOH反应,故D错误;
故选C.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意常见有机物的性质及应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 汤姆生 | B. | 道尔顿 | C. | 拉瓦锡 | D. | 门捷列夫 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X2的电子式为?X??X? | B. | X位于元素周期表中第ⅤA族 | ||
| C. | X元素原子的最外层有7个电子 | D. | X可能位于元素周期表中第二周期 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 构成电池的两极必须是活泼性不同的金属 | |
| B. | 锌锰干电池工作时,锌作负极 | |
| C. | 在电池中,电子流出的一极是负极,发生还原反应 | |
| D. | 银锌纽扣电池工作时,电子由锌极流出经过溶液后流向银极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成.回答下列问题:
早期发现的一种天然二十面体准晶颗粒由Al、Cu、Fe三种金属元素组成.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 元素 | 有关性质或结构信息 |
| A | 负二价的A元素的氢化物在通常状况下是一种液体,其中A的质量分数为88.9% |
| B | B原子得到一个电子后3p轨道全充满 |
| C | C原子的p轨道半充满,它的气态氢化物能与其最高价氧化物的水化物反应生成一种常见的盐X |
| D | D元素的最高化合价与最低化合价的代数和为零,其最高价氧化物水化物的酸性为同主族最强 |
| E | E元素的核电荷数等于A原子的核电荷数和B元素氢化物的核电荷数之和 |
 ,写出该阳离子与硫的氢化物的水溶液反应的离子方程式:2H2O++H2S=S↓+2H2O+2H+.
,写出该阳离子与硫的氢化物的水溶液反应的离子方程式:2H2O++H2S=S↓+2H2O+2H+.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱酸化学式 | CH3 COOH | HCN | H2 CO3 |
| 电离平衡常数 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A. | 等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) | |
| B. | Na2CO3和NaHCO3等物质的量混合的溶液中,一定存在c(Na+)+c(H+)=c(OH-)+c(HCO3-)+c(CO32-) | |
| C. | 0.4mol/L HCN溶液与0.2mol/L NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-)>c(OH-)>c(H+) | |
| D. | 25℃时,浓度均为0.1mol/L的CH3COONa、CH3COOH混合溶液中:c(Na+)+c(H+)>c(CH3COO-)+c(CH3COOH) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 漂白粉的水溶液中:Fe2+、K+、Ca2+、Br- | |
| B. | pH=0的溶液中:Cu2+、Cl-、SO${\;}_{4}^{2-}$、Na+ | |
| C. | 含大量NO3-的溶液:Fe3+、Al3+、SO32-、H+ | |
| D. | 能够与金属Al常温下反应放出气体的溶液:HCO${\;}_{3}^{-}$、Na+、Ca2+、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com