
 科学家在某星球的大气层中探测到N4分子,经研究发现其空间结构与白磷(P4)相似(如图),为正四面体构型,且分子中所有N原子均达到8电子的稳定结构.已知断裂1mol N-N键需要吸收167kJ热量,生成1mol N≡N键需放出942kJ热量.根据以上信息和数据,下列说法中不正确的是( )
科学家在某星球的大气层中探测到N4分子,经研究发现其空间结构与白磷(P4)相似(如图),为正四面体构型,且分子中所有N原子均达到8电子的稳定结构.已知断裂1mol N-N键需要吸收167kJ热量,生成1mol N≡N键需放出942kJ热量.根据以上信息和数据,下列说法中不正确的是( )| A. | N4和N2互为同素异形体,两者之间的转化为非氧化还原反应 | |
| B. | 1mol N4分子的总能量比1mol N2分子的总能量高,说明相同条件下N4分子化学性质更稳定 | |
| C. | N4气体转化为N2的热化学方程式为:N4(g)═2N2(g),△H=-882 kJ•mol-1 | |
| D. | 白磷(P4)的熔、沸点比N4分子的高 |
分析 A、同种元素组成的不同单质为同素异形体,二者转化为化学变化,但元素化合价未变;
B、能量越高越活泼;
C、反应焓变=反应物键能总和-生成物键能总和,标注聚集状态分析判断;
D、分子晶体熔沸点由其相对分子质量判断,相对分子质量越高.熔沸点越高.
解答 解:A、同种元素组成的不同单质为同素异形体,二者转化为化学变化,但元素化合价未变不是氧化还原反应,故A正确;
B、能量越高越活泼,1mol N4分子的总能量比1mol N2分子的总能量高,说明相同条件下N2分子化学性质更稳定,故B错误;
C、反应焓变=反应物键能总和-生成物键能总和=6×167kJ-2×942kJ=-882kJ•mol-1,标注聚集状态得到N4(g)═2N2(g),△H=-882 kJ•mol-1,故C正确;
D、分子晶体熔沸点由其相对分子质量判断,相对分子质量越高,熔沸点越高,白磷(P4)的熔、沸点比N4分子的高,故D正确;
故选B.
点评 本题考查了同素异形体概念分析,反应焓变计算,分子晶体熔沸点判断依据,注意知识积累,题目较简单.


科目:高中化学 来源: 题型:解答题
| 操作 | 现象 | 结论 |
| 将有色鲜花瓣放入干燥的Cl2中 | 过一会儿鲜花瓣褪色 | (1)湿润的氯气具有漂白性 |
| 将干燥的有色布条放入新制的氯水中 | 过一段时间该布条褪色 | |
| 将有色干花瓣放入干燥的Cl2中 | (2)不褪色 | (4)干燥的氯气不具有漂白性 |
| 将干燥的有色布条放入干燥的Cl2中 | (3)不褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C-H之间是sp形成的σ键,C-C之间全是未参加杂化的2p轨道形成的π键 | |
| B. | C-C之间是sp形成的σ键,C-H之间是未参加杂化的2p轨道形成的π键 | |
| C. | sp杂化轨道形成σ键、未杂化的两个2p轨道形成两个π键,且杂化轨道与未杂化轨道互相平行 | |
| D. | sp杂化轨道形成σ键、未杂化的两个2p轨道形成两个π键,且杂化轨道与未杂化轨道互相垂直 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,将0.5molHI气体和0.5molCl2混合后,气体的分子总数为NA | |
| B. | 标准状况下,11.2L的SO3所含分子数为0.5NA | |
| C. | 质量为7.8g的Na2S和Na2O2组成的固体混合物中含有的阴离子数总数为0.1NA | |
| D. | 某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 89.6mL | B. | 112mL | C. | 224 mL | D. | 448mL |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| B. | 煤油可由石油分馏获得,可用作燃料和保存少量金属钠 | |
| C. | 工业上冶炼Al,使用Al2O3而不使用AlCl3,是因为AlCl3是共价化合物,熔融不导电 | |
| D. | 铜具有良好的导电性,常用来制作印刷电路板 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
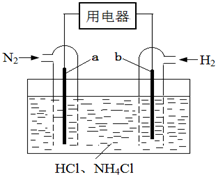 使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液,可制造出一种既能提供电能,又能实现氮固定的新型燃料电池,原理如图所示.下列有关分析正确的是( )
使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液,可制造出一种既能提供电能,又能实现氮固定的新型燃料电池,原理如图所示.下列有关分析正确的是( )| A. | a为电池的负极 | |
| B. | 通入N2一极的电极反应式为:N2+6e-+8H+=2NH4+ | |
| C. | 电池工作一段时间后,溶液pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
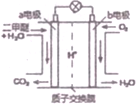 二甲醚是一种绿色、可再生的新能源,如图是绿色电源“燃料电池”的工作原理示意图(a、b均为多孔性Pt电极).该电池工作时,下列说法错误的是( )
二甲醚是一种绿色、可再生的新能源,如图是绿色电源“燃料电池”的工作原理示意图(a、b均为多孔性Pt电极).该电池工作时,下列说法错误的是( )| A. | a电极为该电池负极 | |
| B. | O2在b电极上得电子,被氧化 | |
| C. | 电池工作时,燃料电池内部H+从a电极移向b电极 | |
| D. | 电池工作时,a电极反应式:CH3OCH3-12e-+3H2O═2CO2↑+12H+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com