
ijʵ����Ҫ100 mL��0.1 mol/L��Na2CO3��Һ����ͨ�����²������ƣ�
�ٰѳ����õĹ���Na2CO3����С�ձ��У�����������ˮ�ܽ⡣Ϊ�ӿ��ܽ����ʹ��________(����������)���裻�ڰѢ�������Һ��ȴ�����º�С��ת��________(����������)���ۼ���������ˮ��Һ���̶���1��2 cm��������________(����������)С�ĵμ�����ˮ����Һ��Һ����͵���̶������У�������������ˮϴ�Ӳ��������ձ�2��3�Σ�ÿ��ϴ�ӵ���Һ��С��ת������ƿ��������ҡ�ȣ��ݽ�����ƿ���������ҡ�ȡ�
��1������������ȷ��˳����________(�����)��
��2����û�в����ܣ���������Һ��Ũ�Ȼ�________(�ƫ�ߡ���ƫ�͡�)��
��3����ȡ��20 mL��õ�Na2CO3��Һ��������ˮϡ�ͳ�c(Na��)��0.01 mol/L����Һ����ϡ�ͺ���Һ�����Ϊ________mL��
��4��������100 mL 0.1 mol/L��Na2CO3��Һʱ�����в����е�________�ᵼ�½��ƫ��(���������д)��
����������ƽ����ʱ����������� �ڽ��ձ��е���Һת�Ƶ�����ƿʱ������������ƿ�� �۶���ʱ���ӿ̶��� �ܶ���ʱ���ӿ̶��� �ݸɾ�������ƿδ�����������������Һ
 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ��2016��������Ϫ��һ��ѧ������ѧ�����п�������ѧ�Ծ��������棩 ���ͣ������
�����������еı���Ԫ�أ�����������йص⼰�仯��������ʣ��ش��������⣺
��1�� ʵ��������ȡ������ɲ������·�����
KI + CuSO4 �� A (��ɫ)��+ K2SO4 + I2
16.0 g CuSO4�����KI��Ӧ��ɵ�19.1 g ��A��д��A�Ļ�ѧʽ�� ����ҵ�����У�����������ʯ������NaIO3��Ϊԭ�ϣ���NaHSO3��Ӧ�����ɵ⣬д���˷�Ӧ�����ӷ���ʽ�� ��
��2�����ʵ��������Ӧ�ɵ�IF5��ʵ�����Һ̬IF5����һ���ĵ����ԣ��о���Ա���ֲ�����һ����Ŀ���ԭ������IF5����ż���루�磺2H2O  H3O�� + OH���������ɵ�������Ϊ ��������Ϊ ��
H3O�� + OH���������ɵ�������Ϊ ��������Ϊ ��
��3�������ʵ�����м���ڹ�ʽ��¯�У���������������500��õ���ɫƬ״���壬�˹�������Na2CO3��Һ�ɲ�����ɫ���������塣��д������ʵ������з����Ļ�ѧ��Ӧ����ʽ�� �� ��
��4�� ij��ѧ����С���ú���Ϊԭ���Ƶ������������ӵ���Һ������0.10 mol��L-1�����Ը��������Һ�ζ�20.00 mL����Һ��10.25 mL�������Һ�е����ӵ�Ũ��Ϊ_________mol��L-1����ȷ��0.01����
��5�� I2O5�ǰ�ɫ��ĩ״���壬������������ʹH2S��CO��HC1���������ںϳɰ���ҵ�г���I2O5����������CO�ĺ�������֪��
2I2(s)+5O2(g)=2I2O5(s) ��H=-75.56kJ•mol-1
2CO(g)+O2(g)=2CO2(g) ��H=-566.0kJ•mol-1
д��CO(g)��I2O5(s)��Ӧ������̬I2���Ȼ�ѧ����ʽ�� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�찲��ʡ������ѧ��12�µ��Ĵ��¿���ѧ�Ծ��������棩 ���ͣ�ʵ����
�������������ЧӦ����Դ��ȱ����������ӣ���ν��ʹ�����CO2�ĺ�������Ч�ؿ�������CO2�������˸������ձ����ӡ�
��Ŀǰ��ҵ����һ�ַ�������CO2������ȼ�ϼ״���Ϊ̽����Ӧԭ�����ֽ�������ʵ�飬�����Ϊ1 L���ܱ������У�����1mol CO2��3mol H2��һ�������·�����Ӧ��
CO2(g)��3H2(g)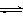 CH3OH(g)��H2O(g) ��H����49.0kJ/mol
CH3OH(g)��H2O(g) ��H����49.0kJ/mol
���CO2��CH3OH(g)��Ũ����ʱ��仯��ͼ��ʾ��
�ٴӷ�Ӧ��ʼ��ƽ�⣬������ƽ����Ӧ����v(H2)��___________mol/(L��min)��
�ڸ÷�Ӧ��ƽ�ⳣ������ʽΪ__________________��
�����д�ʩ����ʹn(CH3OH)��n(CO2)�������___________��
A�������¶� B������He(g)��ʹ��ϵѹǿ����
C����H2O(g)����ϵ�з��� D���ٳ���1mol CO2��3mol H2
�������˺���������̬ϵͳ�У�����Ҫ�����ȥ��CO2����Ҫ���ṩ�����O2��ij�ֵ绯ѧװ�ÿ�ʵ������ת����2 CO2��2 CO��O2��CO������ȼ�ϡ�
��֪�÷�Ӧ��������ӦΪ��4OH�D�D4e�D��O2����2H2O
��������ӦʽΪ��________________________________��
���������������Ʒ�Ӧ2CO��2C��O2����H��0����S��0��������CO����Ⱦ�������ж��Ƿ���в�˵�����ɣ�__________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016��ӱ�ʡ������ѧ�ڵ������¿���ѧ�Ծ��������棩 ���ͣ������
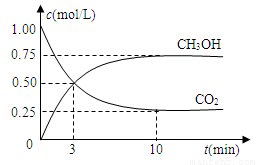
����ԭ�������ĵ��������ֶ�����Ԫ��ԭ�Ӱ뾶����Դ�С��������ۻ������,��ͼ��ʾ��
��1��Ԫ��Zλ��Ԫ�����ڱ��ĵ� ���� �壬X��Z���γ�18���ӵĻ�����û�����ĵ���ʽΪ ��
��2���ǽ�����: Y (� >����<��)D��
��3������F��EDX��Һ��Ӧ�Ļ�ѧ����ʽΪ ��
��4��G��H���γ�һ�ֻ��������Է���������90〜110֮�䣬��G����������ԼΪ31��1%���û�����Ļ�ѧʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�������ʡ������ѧ��12���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
�ڴ�����400��ʱ��ʵ���ȵ�ѭ�����ã���ͼ����������ϵͼ�����з�����ȷ���ǣ� ��

A������a��ʹ���˴����������仯����
B����Ӧ����ܼ��ܸ�����������ܼ���
C����Ӧ���Ȼ�ѧ����ʽΪ��4HCl��g��+O2��g�� 2Cl2+2H2O��g����H=��115.6 kJ•mol��1
2Cl2+2H2O��g����H=��115.6 kJ•mol��1
D������Ӧ����2molҺ̬ˮ���ų�����������115.6 kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ����ϳ���ʯ�ŵ�һ��ѧ��һ�����л�ѧ�Ծ��������棩 ���ͣ�ѡ����
��NA��ʾ����������������������ȷ���ǣ� ��
A����״���£�22.4LH2O���еķ�����Ϊ1 NA
B�����³�ѹ��,1.06g Na2CO3���е�Na+������Ϊ0.02 NA
C��ͨ��״���£�1 NA ��CO2����ռ�е����Ϊ22.4L
D�����ʵ���Ũ��Ϊ0.5mol��/L��MgCl2��Һ�У�����Cl- ����Ϊ1 NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�������ʡ������ѧ��12���¿���ѧ�Ծ��������棩 ���ͣ�ѡ����
��MgCl2��AlCl3��Ϊn mol�Ļ����Һ�������е�NaOH��Һ������������NaOH�����ʵ��������ɳ��������ʵ����Ĺ�ϵ��ȷ���ǣ����ӻ����ʣ�����pH���±����� ��
���� | Mg2+ | Al 3+ | ���� | Al(OH)3 |
��ʼ����pH | 8.93 | 3.56 | ��ʼ�ܽ�pH | 8.04 |
��ȫ����pH | 10.92 | 4.89 | ��ȫ�ܽ�pH | 12.04 |
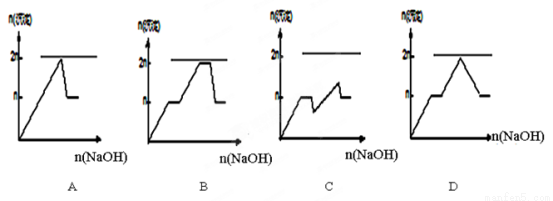
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2016�켪��ʡ�����ϵ�����ģ�⻯ѧ�Ծ��������棩 ���ͣ�ѡ����
����������Ԫ��X��Y��Z��W��Q��ԭ��������������X����̬�⻯�K������Y���⻯���У������£�Z�ĵ���������W������������ˮ�����ϡ��Һ��ȴ��������Ũ��Һ������˵������ȷ���ǣ� ��
A��ԭ�Ӱ뾶�Ĵ�С˳��ΪW��Q��Z��X��Y
B��Ԫ��X����̬�⻯����Q�ĵ��ʿɷ����û���Ӧ
C��Ԫ��X��Y�����γ�5�����ϵĻ�����
D��Ԫ��Q������������Ӧ��ˮ�������Ա�W��ǿ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2015-2016ѧ�����������·��һ��ѧ��һ�϶ο���ѧ�Ծ��������棩 ���ͣ�ѡ����
���и������ʷ�����ȷ����
�� | �� | �� | ������ | |
A | ���� | ���� | ����� | ������ |
B | ���� | �ռ� | ���� | ������ |
C | ̼�� | ����� | ̼���� | �ɱ� |
D | �ɱ� | ������ | ʳ�� | ʯ��ʯ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com