
(10分)汽车尾气是城市空气的主要污染物,如何减少汽车尾气(CO、NOx等)的污染是重要的科学研究课题。
(1) 已知:N2(g) + O2(g) 2NO(g) ΔH1
2NO(g) ΔH1
N2(g) + 3H2(g) 2NH3(g) ΔH2
2NH3(g) ΔH2
2H2(g) + O2(g) 2H2O(g) ΔH3
2H2O(g) ΔH3
则4NO(g) + 4NH3(g) + O2(g) 4N2(g) + 6H2O(g) ΔH =____________(用ΔH1、ΔH2、ΔH3表达)
4N2(g) + 6H2O(g) ΔH =____________(用ΔH1、ΔH2、ΔH3表达)
(2) 在密闭容器中,一定条件下,进行如下反应:2NO(g)+2CO(g) N2(g)+2CO2(g),下列说法不能说明该反应达到平衡的是__________ (填字母)
N2(g)+2CO2(g),下列说法不能说明该反应达到平衡的是__________ (填字母)
A.NO的生成速率与NO的消耗速率相等
B.v(CO)=v(CO2)
C.体系的压强保持不变
D.各物质的浓度保持不变
(3) 可用活性炭还原法处理氮氧化物。有关反应的化学方程式为:
C(s) + 2NO(g) N2(g) + CO2(g) ΔH >0
N2(g) + CO2(g) ΔH >0
某研究小组向密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
浓度/mol·L-1
| NO | N2 | CO2 |
0
| 0.100
| 0
| 0
|
10
| 0.058
| 0.021
| 0.021
|
20
| 0.040
| 0.030
| 0.030
|
30
| 0.040
| 0.030
| 0.030
|
40
| 0.032
| 0.034
| 0.017
|
① 写出该反应的平衡常数表达式:K= 。
② 30 min后,改变某一条件,平衡发生了移动,则改变的条件是 ;若升高温度,NO浓度将 (填“增大”、“不变”或“减小”)。
(1)3△H3-2△H1-2△H2 (2)B
(3)① 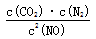 ②减少CO2浓度或移出部分CO2;减小
②减少CO2浓度或移出部分CO2;减小
【解析】
试题分析:(1)已知:①N2(g)+O2(g)═2NO(g)△H1,②N2(g)+3H2(g)?2NH3(g)△H2,③2H2(g)+O2(g)═2H2O(g)△H3,依据盖斯定律3×③-①×2-②×2得到热化学方程式为:4NO(g)+4NH3(g)+O2(g)═4N2(g)+6H2O(g)△H=(3△H3-2△H1-2△H2)KJ/mol;
(2)2NO(g)+2CO(g) N2(g)+2CO2(g),反应是气体体积减小的反应,则A.NO的生成速率与NO的消耗速率相等是平衡标志,故A正确;B.反应速率之比等于化学方程式计量数之比,为正反应速率之比,v(CO)=v(CO2)不能说明反应达到平衡状态,故B错误;C.反应前后气体物质的量变化,体系的压强保持不变说明反应达到平衡状态,故C正确;D.各物质的浓度保持不变是平衡标志,故D正确;故选B;
N2(g)+2CO2(g),反应是气体体积减小的反应,则A.NO的生成速率与NO的消耗速率相等是平衡标志,故A正确;B.反应速率之比等于化学方程式计量数之比,为正反应速率之比,v(CO)=v(CO2)不能说明反应达到平衡状态,故B错误;C.反应前后气体物质的量变化,体系的压强保持不变说明反应达到平衡状态,故C正确;D.各物质的浓度保持不变是平衡标志,故D正确;故选B;
(3)①C(s)+2NO(g) N2(g)+CO2(g)△H>0,固体不写入平衡常数表达式,平衡常数K=
N2(g)+CO2(g)△H>0,固体不写入平衡常数表达式,平衡常数K=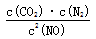 ;
;
②根据表中数值知,NO、二氧化碳的浓度减小,氮气的浓度增大,说明改变条件是分离出二氧化碳物质,反应是吸热反应,升温平衡正向进行,一氧化氮浓度减小。
考点:考查热化学方程式和盖斯定律计算应用,化学平衡标志的理解分析,反应速率,平衡常数计算应用


科目:高中化学 来源:2015届广东省揭阳市高三上学期第一次阶段考试理综试卷(解析版) 题型:填空题
(16分)香兰素(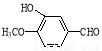 )是食品添加剂的增香原料,其合成路线如下:
)是食品添加剂的增香原料,其合成路线如下:
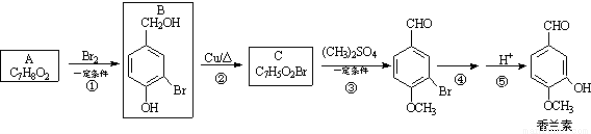
(1)写出A的结构简式 ,1 mol A完全反应消耗O2的物质的量为 mol。
(2)写出反应②的化学方程式_______________________________。
(3)反应③的反应类型是_____,1 mol香兰素在一定条件下与H2发生反应,最多消耗H2_________mol。
(4)D与香兰素互为同分异构体,能与NaHCO3溶液反应放出气体,遇FeCl3溶液显紫色,且苯环上的一氯取代物只有2种,请写出D的结构简式______。
(5)香兰素的另一种同分异构体结构简式为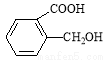 ,在一定条件下可以合成聚酯高分子,写出该聚酯高分子的结构简式_________。
,在一定条件下可以合成聚酯高分子,写出该聚酯高分子的结构简式_________。
查看答案和解析>>
科目:高中化学 来源:2015届广东省广州市高三上学期期中考试理综化学试卷(解析版) 题型:选择题
常温下在下列给定条件的溶液中,一定能大量共存的离子组是
A.能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3—
B.加入铝粉生成H2的溶液:K+、Mg2+、SO42—、HCO3—
C.c(Fe3+)=0.1 mol·L-1的溶液:H+、Al3+、Cl-、SCN-
D.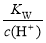 =0.1 mol·L-1的溶液:Na+、K+、SiO32—、NO3—
=0.1 mol·L-1的溶液:Na+、K+、SiO32—、NO3—
查看答案和解析>>
科目:高中化学 来源:2015届广东省佛山市高三10月月考化学试卷(解析版) 题型:填空题
(16分)碳、氮、硫、氯是四种重要的非金属元素。
(1)CH4(g)在O2(g)中燃烧生成CO(g)和H2O(g)的△H难以直接测量,原因是
(2)工业上合成氨气的反应为:N2(g) + 3H2(g)  2NH3(g) △H<0。现将10 mol N2和26 mol H2置于容积可变的密闭容器中,N2的平衡转化率(
2NH3(g) △H<0。现将10 mol N2和26 mol H2置于容积可变的密闭容器中,N2的平衡转化率(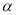 )与体系总压强(P)、温度(T)的关系如图所示。
)与体系总压强(P)、温度(T)的关系如图所示。
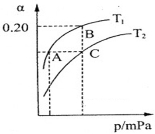
回答下列问题:
①反应达到平衡状态B时,容器的容积10 L,则T1时,合成氨反应的平衡常数K= 。
②平衡状态由A变到C时,对应的平衡常数K(A) K(C)(填“>”、“<”或“=”)。
③平衡状态由A变到B时,对应的平衡常数K(A) K(B)(填“>”、“<”或“=”)。
(3)在25℃时,HSCN、HClO、H2CO3的电离常数如下表:
HClO | HSCN | H2CO3 |
K=3.2×10-8 | K=0.13 | Kl=4.2×10-7 K2=5.6×10-11 |
①1 mol·L-1的KSCN溶液中,所有离子的浓度由大到小的顺序为
②向Na2CO3溶液中加入过量HClO溶液,反应的化学方程式为
③同浓度的A.NaClO B. Na2CO3 C. NaSCN 比较各溶液pH由大到小的是 (用A.B.C回答)
查看答案和解析>>
科目:高中化学 来源:2015届广东省佛山市高三10月月考化学试卷(解析版) 题型:选择题
下列关于金属铝的叙述中,说法正确的是
A.Al是地壳中含量最多的元素
B.与Al反应产生H2的溶液一定呈酸性
C.Al是比较活泼的金属,在化学反应中容易失去电子,表现氧化性
D.铝箔在空气中受热可以熔化,由于氧化膜的存在,熔化的铝并不滴落
查看答案和解析>>
科目:高中化学 来源:2015届广东省佛山市高三9月考化学试卷(解析版) 题型:选择题
短周期元素的X、Y、Z、W原子序数依次增大,X原子最外层电子数是电子层数的三倍,Y与X可形成Y2X2和Y2X两种离子化合物,Z原子的核外电子数比原子Y原子多1,W与X同主族,则
A.气态氢化物的稳定性:X>W
B.单质的还原性:Y>Z
C.原子半径:Y<Z<W
D.Y和Z两者最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源:2015届广东省佛山市高三9月考化学试卷(解析版) 题型:选择题
在容积为2L的密闭容器中进行反应:CO(g)+2H2(g) CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图所示,下列说法正确的是
CH3OH(g) ,其他条件不变,在300℃和500℃时,物质的量n(CH3OH)-反应时间t的变化曲线如图所示,下列说法正确的是
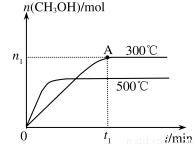
A.该反应的△H>0
B.其他条件不变,升高温度反应的平衡常数增大
C.300℃时,0-t1min内 CH3OH的平均生成速率为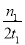 mol·L-1 min-1
mol·L-1 min-1
D.A点的反应体系从300℃升高到500℃,达到平
衡时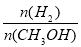 减小
减小
查看答案和解析>>
科目:高中化学 来源:2015届广东省中山市高三上学期第二次模拟考试化学试卷(解析版) 题型:实验题
(12分)从铝土矿(主要成分是Al2O3,含SiO2、Fe2O3、MgO等杂质)中提取氧化铝的两种工艺流程如下:
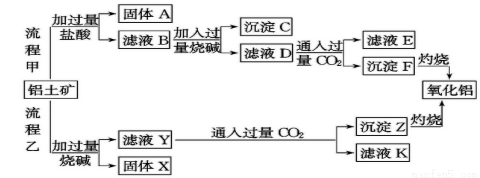
请回答下列问题:
(1)流程甲加入盐酸后生成Al3+的离子方程式为: ;
(2)流程乙加入烧碱后生成SiO32-的离子方程式为______。
(3)验证滤液B含Fe3+,可取少量滤液并加入______(填试剂名称)。
(4)滤液E中溶质的主要成分是____(填化学式),写出该溶液的一种用途 。
查看答案和解析>>
科目:高中化学 来源:2015届广东省东莞市高三第一次调研考试理科化学试卷(解析版) 题型:选择题
常温下,Na2CO3溶液中存在平衡:CO32-+H2O HCO3-+OH-,下列有关该溶液的说法正确的是
HCO3-+OH-,下列有关该溶液的说法正确的是
A.离子浓度:c(Na+)>c(CO32-)>c(OH-)>c(H+)
B.升高温度,平衡向右移动
C.滴入CaCl2浓溶液,溶液的pH增大
D.加入NaOH固体,溶液的pH减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com