
【题目】下列不能使有色布条褪色的物质是
A. 次氯酸钠溶液 B. 氯水 C. 漂白粉溶液 D. 氯化钙溶液
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种短周期元素,它们的原子序数依次增大;A元素的原子半径最小;B元素的最高价氧化物对应水化物与其氢化物能生成盐;D与A同主族,且与E同周期;E元素原子的最外层电子数是其次外层电子数的3/4;A、B、D、E这四种元素,每一种与C元素都能形成原子个数比不相同的若干种化合物。请回答下列问题:
(1)B和A形成的10电子化合物的电子式是_______
(2)A、B、C、E可形成两种酸式盐(均由四种元素组成),两种酸式盐相互反应的离子方程式为_________
(3)A、C、E间可形成甲、乙两种微粒,它们均为负一价双原子阴离子,且甲有18个电子,乙有10个电子,则甲和乙反应的离子方程式为________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ写出下列化学反应方程式 :①苯的硝化反应: ________ ②淀粉水解的化学方程式: __________
Ⅱ写出下列物质的电子式 :CaCl2________;HClO________;Na2O2________;CO2________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组要完成中和热的测定。
(1)实验桌上备有大、小两个烧杯、泡沫塑料、泡沫塑料板、胶头滴管、环形玻璃搅拌棒、0.5 mol·L-1盐酸、0.55 mol·L-1 NaOH溶液,实验尚缺少的玻璃用品是___________、___________。
(2)实验中能否用环形铜丝搅拌棒代替环形玻璃搅拌棒___________(填“能”或“否”),其
原因是 。
(3)他们记录的实验数据如下:

已知:Q=cm(t2-t1),反应后溶液的比热容c为4.18 kJ·℃-1·kg-1,各物质的密度均为1 g·cm-3。
①计算完成上表ΔH=_____________。
②根据实验结果写出NaOH溶液与HCl溶液反应的热化学方程式: 。
(4)若用KOH代替NaOH,对测定结果__________(填“有”或“无”)影响;若用醋酸代替HCl做实验,对测定结果____________(填“有”或“无”)影响。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在无色溶液中大量共存的一组离子是
A. Cu2+、SO42—、OH—、K+ B. Fe3+、NO3—、Cl—、H+
C. K+、CO32—、Cl—、H+ D. H+、Na+、Cl—、SO42—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上以乙醇为原料经一系列反应可以得到4-羟基扁桃酸和香豆素-3-羧酸,二者的合成路线如下(部分产物及条件未列出):
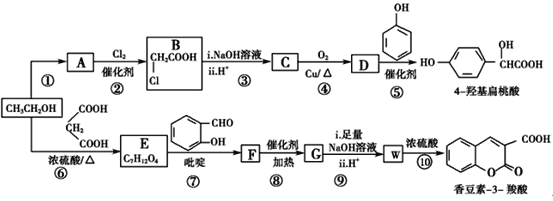
已知:Ⅰ.RCOOR′+R″OH![]() RCOOR″+R′OH;
RCOOR″+R′OH;
Ⅱ. 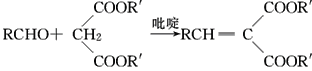 (R,R′,R″表示氢原子、烷基或芳基)
(R,R′,R″表示氢原子、烷基或芳基)
回答下列问题:
(1)反应②属于取代反应,则A中官能团的名称是________
(2)  的名称是________,反应⑤的反应类型为________。
的名称是________,反应⑤的反应类型为________。
(3)反应⑥的化学方程式是________________________________________。
(4)已知G分子中含有2个六元环。下列有关说法正确的是________(填标号)。
a.核磁共振仪可测出E有5种类型的氢原子
b.质谱仪可检测F的最大质荷比的值为236
c.G分子式为C12H10O4
d.化合物W能发生加聚反应得到线型高分子化合物
(5)某芳香化合物Q是4-羟基扁桃酸的同分异构体,具有下列特征:①苯环上只有3个取代基;②能发生水解反应和银镜反应;③1 mol Q最多能消耗3 mol NaOH。Q共有________种(不含立体异构)
(6)仔细观察由乙醇合成香豆素-3-羧酸的过程,结合相关信息,当乙醇与丙二酸的物质的量的比为________时,只许3步即可完成合成路线。请写出合成路线_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不锈钢表面用硝酸和氢氟酸的混酸处理后,产生的酸洗废液中含有Fe3+、Ni2+、NO3-、F-和+6价铬的含氧酸根离子等.如图是综合利用该酸洗废液的工艺流程:
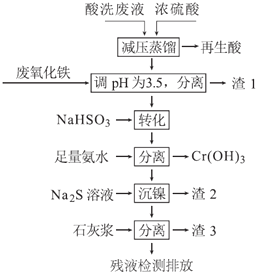
已知:
①金属离子开始沉淀和沉淀完全时的pH:
Fe3+ | Ni2+ | Cr3+ | |
开始沉淀 | 1.5 | 6.7 | 4.0 |
沉淀完全 | 3.4 | 9.5 | 6.9 |
②Ni2+与足量氨水的反应为:Ni2++6NH3[Ni(NH3)6]2+
(1)再生酸中含有______,采取减压蒸馏的原因是______(用化学方程式表示).
(2)利用废氧化铁(主要成分为Fe2O3)代替烧碱调节pH的好处是______.
(3)请写出“转化”时NaHSO3与Cr2O72-发生反应的离子反应方程式:______.
(4)已知[Ni(NH3)6]2+为难电离的络合离子,则“沉镍”的离子方程式为:______.
(5)滤渣3的主要成分为Ca(OH)2和_________________________.
(6)经检测,最后的残液中c(Ca2+)=0.004molL-1,则残液中F-浓度为______mgL-1,[已知Ksp(CaF2)=4×10-11mol3L-3.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2O2可用作漂白剂和呼吸面具中的供氧剂。
(1)某学习小组发现:在盛有Na2O2的试管中加入足量水,立即产生大量气泡,当气泡消失后,向其中滴入1~2滴酚酞试液,溶液变红;将试管轻轻振荡,红色很快褪去;此时再向试管中加入少量MnO2粉末,又有气泡产生。
①使酚酞试液变红是因为____________________________________,红色褪去的可能原因是____________________________________________。
②加入MnO2反应的化学方程式为_______________________________。
(2)Na2O2有强氧化性,H2具有还原性,有同学猜想Na2O2与H2能反应。为了验证此猜想,该小组同学进行如下实验,实验步骤和现象如下。
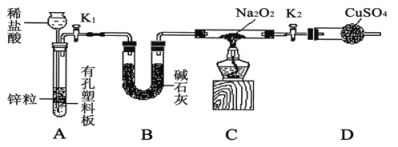
步骤1:按如图组装仪器(图中夹持仪器省略),检查气密性,装入药品;
步骤2:打开K1、K2,产生的氢气流经装有Na2O2的硬质玻璃管,一段时间后,没有任何现象;
步骤3:检验H2的纯度后,开始加热,观察到硬质玻璃管内Na2O2开始熔化,淡黄色的粉末变成了白色固体,干燥管内硫酸铜未变蓝色;
步骤4:反应后撤去酒精灯,待硬质玻璃管冷却后关闭K1。
①盛装稀盐酸的仪器名称___________;B装置的作用是______________。
②必须检验氢气纯度的原因是_________________。
③设置装置D的目的是___________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学-有机化学基础]
已知:![]()
为合成某种液晶材料的中间体M,有人提出如下不同的合成途径
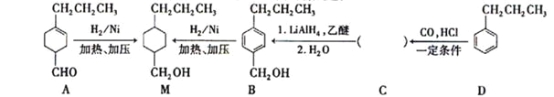
(1)常温下,下列物质能与A发生反应的有_______(填序号)
a.苯 b.Br2/CCl4 c.乙酸乙酯 d.KMnO4/H+溶液
(2)M中官能团的名称是____,由C→B反应类型为________。
(3)由A催化加氢生成M的过程中,可能有中间生成物![]() 和______(写结构简式)生成
和______(写结构简式)生成
(4)检验B中是否含有C可选用的试剂是_____(任写一种名称)。
(5)物质B也可由C10H13Cl与NaOH水溶液共热生成,C10H13Cl的结构简式为______。
(6)C的一种同分异构体E具有如下特点:
a.分子中含—OCH3CH3b.苯环上只有两种化学环境不同的氢原子
写出E在一定条件下发生加聚反应的化学方程式__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com