

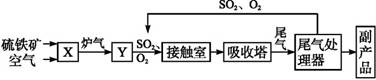
| A.二氧化硫的接触氧化在接触室中发生 |
| B.吸收塔用浓度为98.3%浓硫酸吸收三氧化硫 |
| C.煅烧含硫48%的黄铁矿时,若FeS2损失了2%,则S损失2% |
| D.B装置中反应的条件之一为较高温度是为了提高SO2的转化率 |
 2Fe2O3 + 8SO2 (2)D、E
2Fe2O3 + 8SO2 (2)D、E Na2CO3 + CO2↑+ H2O
Na2CO3 + CO2↑+ H2O  2Fe2O3 + 8SO2。(2)A.在接触室中发生反应:2SO2+O2
2Fe2O3 + 8SO2。(2)A.在接触室中发生反应:2SO2+O2 2SO3因此该选项正确。B.如果用水吸收SO3,容易形成酸雾,不利于SO3的吸收。所以在吸收塔中一般是用98.3%浓硫酸吸收三氧化硫形成发烟硫酸,然后再稀释成所需要的浓度。正确。C.C.煅烧含硫48%的黄铁矿时,若FeS2损失了2%,则其中各组分的损失也都是2%.这与物质的组成无关。正确。D.在设备B中发生的反应2SO2+O2
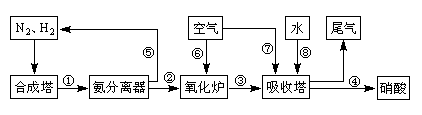
2SO3因此该选项正确。B.如果用水吸收SO3,容易形成酸雾,不利于SO3的吸收。所以在吸收塔中一般是用98.3%浓硫酸吸收三氧化硫形成发烟硫酸,然后再稀释成所需要的浓度。正确。C.C.煅烧含硫48%的黄铁矿时,若FeS2损失了2%,则其中各组分的损失也都是2%.这与物质的组成无关。正确。D.在设备B中发生的反应2SO2+O2 2SO3为放热反应,如果升高温度,根据平衡移动原理,升高温度,化学平衡会向吸热反应方向移动,对该反应来说就是向逆反应方向移动。这对于提高SO2的转化率不利。之所以采用较高的温度,是为了加快化学反应速率,缩短达到平衡所需要的时间。提高生产效率。错误。E.硫酸工业中在接触室安装热交换器是为了利用SO2氧化为SO3时的热量。错误。Ⅱ.(3)“联合制碱法”中CO2的来源于合成氨厂;“氨碱法”中CO2来源于煅烧石灰石。(4)氨碱法的化学反应原理为:NH3+CO2+H2O==NH4HCO3;NaCl+NH4HCO3==NaHCO3↓+NH4Cl 2NaHCO3
2SO3为放热反应,如果升高温度,根据平衡移动原理,升高温度,化学平衡会向吸热反应方向移动,对该反应来说就是向逆反应方向移动。这对于提高SO2的转化率不利。之所以采用较高的温度,是为了加快化学反应速率,缩短达到平衡所需要的时间。提高生产效率。错误。E.硫酸工业中在接触室安装热交换器是为了利用SO2氧化为SO3时的热量。错误。Ⅱ.(3)“联合制碱法”中CO2的来源于合成氨厂;“氨碱法”中CO2来源于煅烧石灰石。(4)氨碱法的化学反应原理为:NH3+CO2+H2O==NH4HCO3;NaCl+NH4HCO3==NaHCO3↓+NH4Cl 2NaHCO3 Na2CO3 + CO2↑+ H2O ;2NH4Cl+Ca(OH)2
Na2CO3 + CO2↑+ H2O ;2NH4Cl+Ca(OH)2 CaCl2+2NH3↑+2H2O。CO2、NH3循环利用。在该方法中,目标产物为Na2CO3;实际产物为Na2CO3和CaCl2。所以原子利用率为[106÷(106+111)]×100%=49%(或106/217)。(5) “联合制碱法”有关反应的化学方程式为NH3 + H2O + CO2 + NaCl(饱和)= NaHCO3 ↓+ NH4Cl; 2NaHCO3
CaCl2+2NH3↑+2H2O。CO2、NH3循环利用。在该方法中,目标产物为Na2CO3;实际产物为Na2CO3和CaCl2。所以原子利用率为[106÷(106+111)]×100%=49%(或106/217)。(5) “联合制碱法”有关反应的化学方程式为NH3 + H2O + CO2 + NaCl(饱和)= NaHCO3 ↓+ NH4Cl; 2NaHCO3 Na2CO3 + CO2↑+ H2O。
Na2CO3 + CO2↑+ H2O。

科目:高中化学 来源:不详 题型:问答题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 CO2(g)+H2(g) ΔH<0。欲提高CO转化率可采用的方法可能有:①降低温度;②增大压强 ③使用催化剂 ④增大CO的浓度;⑤增大水蒸气的浓度,其中正确的组合是( )。
CO2(g)+H2(g) ΔH<0。欲提高CO转化率可采用的方法可能有:①降低温度;②增大压强 ③使用催化剂 ④增大CO的浓度;⑤增大水蒸气的浓度,其中正确的组合是( )。| A.①②③ | B.④⑤ | C.①⑤ | D.⑤ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.制普通玻璃的主要原料是纯碱、石灰石、石英砂 |
| B.工业上电解熔融的氯化钠来制取钠 |
| C.将二氧化硫催化成三氧化硫后,在吸收塔内用水吸收制得浓硫酸 |
| D.制造普通水泥的主要原料是黏土、石灰石 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
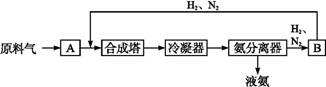
 2NH3(g) ΔH<0; 2SO2(g)+O2(g)
2NH3(g) ΔH<0; 2SO2(g)+O2(g) 2SO3(g) ΔH<0
2SO3(g) ΔH<0查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 NH2COONH4;NH2COONH4
NH2COONH4;NH2COONH4 CO(NH2)2+H2O
CO(NH2)2+H2O| A.NO2与H2O的反应生成HNO3和NO | B.NO与O2反应生成NO2 |
| C.NH3经催化氧化生成NO | D.N2 蛋白质 蛋白质 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.神七宇航员所穿航天服是由我国自行研制的新型“连续纤维增韧”航空材料做成,其主要成分是由碳化硅、陶瓷和碳纤维复合而成的,它是一种新型无机非金属材料 |
| B.食品包装袋、食物保鲜膜等材料的主要成份是聚氯乙烯 |
| C.人体内没有能使纤维素水解成葡萄糖的酶,因此纤维素不能作为人类的营养食物 |
| D.针对病毒性流感的扩散情况,要加强环境、个人等的消毒预防,其中消毒剂常选用含氯消毒剂、酒精、双氧水等适宜的物质 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
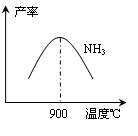
 CO2+H2。t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=_____(填计算结果)。
CO2+H2。t℃时,往1L密闭容器中充入0.2mol CO和0.3mol水蒸气。反应建立平衡后,体系中c(H2)=0.12mol·L-1。该温度下此反应的平衡常数K=_____(填计算结果)。 2NH3(g) △H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1____300℃(填“>”、“<”或“=”)。
2NH3(g) △H<0。下表为不同温度下该反应的平衡常数。由此可推知,表中T1____300℃(填“>”、“<”或“=”)。| T/℃ | T1 | 300 | T2 |
| K | 1.00×107 | 2.45×105 | 1.88×103 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.土壤胶体吸附的H+、Al3+被其他阳离子交换 |
| B.微生物、细菌在利用土壤中的有机物时,会产生二氧化碳和多种有机酸 |
| C.微生物、细菌在利用土壤中物质时,将土壤中的NH3转化为亚硝酸和硝酸,将硫化物转化为硫酸 |
| D.土壤有机物中的氮被微生物分解生成氨的氨化过程,会使土壤的pH升高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com