
【题目】位于3个不同短周期的主族元素a、b、c、d、e,原子序数依次增大,其中b、d同主族,d元素最高化合价与最低化合价代数和等于4,c原子最外层电子数比b原子次外层电子数多1,回答下列问题。
(1)写出a的元素符号_____,b在周期表中的位置是第___周期____族;
(2)a与e形成的是_____(填“离子”或“共价”)化合物;
(3)上述五种元素中,非金属性最强的是______(填元素名称);
(4)d元素最高价氧化物对应水化物的化学式是______,d和e的气态氢化物稳定性强的是_________(填化学式);
(5)元素c的原子结构示意图为____;c的单质与a的同主族第3周期元素最高价氧化物对应水化物反应的离子方程式为____________。
【答案】 H 2 VIA 共价 氧 H2SO4 HCl ![]() 2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑
2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑
【解析】位于3个不同短周期的主族元素a、b、c、d、e,原子序数依次增大,则a是H。其中b、d同主族,d元素最高化合价与最低化合价代数和等于4,位于第ⅥA族,则b是O,d是S,所以e是Cl。c原子最外层电子数比b原子次外层电子数多1,c是Al,据此解答。
根据以上分析可知a是H,b是O,c是Al,d是S,e是Cl。则
(1)a的元素符号H,氧元素在周期表中的位置是第二周期第VIA族;
(2)a与e形成的是氯化氢,含有共价键的共价化合物;
(3)同主族从上到下非金属性逐渐减弱,同周期自左向右非金属性逐渐增强,则上述五种元素中,非金属性最强的是氧;
(4)S元素最高价氧化物对应水化物的化学式是H2SO4。氯元素非金属性强于硫元素,则d和e的气态氢化物稳定性强的是HCl;
(5)元素Al的原子结构示意图为![]() ;c的单质与a的同主族第3周期元素最高价氧化物对应水化物氢氧化钠反应的离子方程式为2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑。
;c的单质与a的同主族第3周期元素最高价氧化物对应水化物氢氧化钠反应的离子方程式为2Al+2OH-+6H2O=2[Al(OH)4]-+3H2↑。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下面是某工厂利用电镀污泥(主要含有Fe2O3、CuO、Cr2O3及部分难溶杂质)回收铜和铬的流程:

请回答下列问题:
已知部分物质沉淀的pH及CaSO4的溶解度曲线如下:
(1)在浸出过程中除生成Cr2(SO4)3外,主要还生成__________________。
(2)流程中“第一次调节“pH”是为了除去Fe3+,所加试剂X可以是_______(任写一种)。当离子浓度小于或等于1×10-5时可认为沉淀完全,若要使Fe3+完全沉淀,则应调节溶液pH≥__________已知(Ksp[Fe(OH)3]=8×10-38,1g2=0.3)
(3)写出还原步骤中生成Cu2O沉淀反应的离子方程式______________________________。此步骤中若NaHSO3过量。除了浪费试剂外,还可能出现的问题是________________________。
(4)流程中“第二次调节pH”应小于9,因为Cr(OH)3是两性氢氧化物,试写出Cr(OH)3与NaOH溶液反应的离子方程式___________________________。
(5)Cr(OH)3受热分解为Cr2O3,再用铝热法可以得到金属Cr。写出其中用铝热法冶炼得到金属Cr的化学方程式________________________________。
(6)化学需氧量(COD)可量度水体受有机物污染的程度,以K2Cr2O7作强氧化剂处理水样时所消耗的K2Cr2O7的量换算成相当于O2的含量(以mg·L-1计)来计量。
①处理时,水样应先酸化,最好选用__________(选填“稀硝酸”、“稀硫酸”或“稀盐酸”)酸化。
②在该条件下,Cr2O72-最终转化为Cr3+、取水样100mL,处理该水样时消耗了10mL0.025 mol·L-1 K2Cr2O7溶液。则该水样的COD为__________ mg·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】等物质的量的CO和CO2相比较,下列有关叙述中不正确的是
A.分子数目之比为1:1B.氧原子数目之比为1:2
C.原子总数目之比为3:2D.碳原子数目之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L密闭容器中进行反应:mX(g)+nY(g) ![]() pZ(g)+qQ(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质物质的量的变化如下表所示:
pZ(g)+qQ(g),式中m、n、p、q为化学计量数。在0~3 min内,各物质物质的量的变化如下表所示: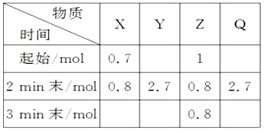
已知2 min内v(Q)=0.075 mol·L-1·min-1 , v(Z)∶v(Y)=1∶2。
(1)试确定:起始时n(Y)= , n(Q)=。
(2)方程式中m= , n= , p= , q=。
(3)用Z表示2 min内的反应速率。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知450℃时,反应H2(g)+I2(g) ![]() 2HI(g)的K=50,由此推测在450℃时,反应2HI(g)
2HI(g)的K=50,由此推测在450℃时,反应2HI(g) ![]() H2(g)+I2(g)的化学平衡常数为( )
H2(g)+I2(g)的化学平衡常数为( )
A.50
B.0.02
C.100
D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应2SO2(g)+O2(g) ![]() 2SO3(g) △H<0一定条件下在某密闭容器中达到平衡。t1时改变某一条件,反应速率与时间关系如下图。下列说法中正确的是( )
2SO3(g) △H<0一定条件下在某密闭容器中达到平衡。t1时改变某一条件,反应速率与时间关系如下图。下列说法中正确的是( )
A.维持温度、反应体系体积不变,t1时充入SO3(g)
B.维持压强不变,t1时升高反应体系温度
C.维持温度不变,t1时扩大反应体系体积
D.维持温度、容器体积不变,t1时充入SO3(g),同时减少SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关胶体的说法不正确的是( )
A.氢氧化铁胶体具有吸附性,可做净水剂
B.向FeCl3溶液中滴加NaOH溶液,可制得Fe(OH)3胶体
C.可用丁达尔效应鉴别氢氧化铁胶体和水
D.盐卤点豆腐、江河入海口处“三角洲”的形成、高压直流电除烟尘均与胶体的性质有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1 mol/L CH3COOH溶液中存在如下电离平衡:CH3COOH ![]() CH3COO-+H+ , 对于该平衡,下列叙述正确的是( )
CH3COO-+H+ , 对于该平衡,下列叙述正确的是( )
A.加入水时,平衡逆向移动
B.加入少量NaOH固体,平衡正向移动
C.加入少量0.1 mol/L HCl溶液,溶液中c(H+)不变
D.加入少量CH3COONa固体,平衡正向移动
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com