
控制适合的条件,将反应2Fe3++2I-2Fe2++I2设计成如下图所示的原电池。下列判断不正确的是 ( )
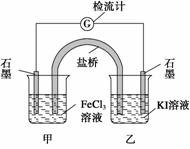
A.反应开始时,乙中石墨电极上发生氧化反应
B.反应开始时,甲中石墨电极上Fe3+被还原
C.检流计读数为零时,反应达到化学平衡状态
D.检流计读数为零后,在甲中溶入FeCl2固体,乙中的石墨电极为负极
科目:高中化学 来源: 题型:
常常利用物质的酸碱性分离混合液。某一混合液含苯酚、苯甲醇、苯甲酸和苯胺四种物质,其分离方案如下图:

已知:苯甲醇、苯甲酸、苯胺微溶于水。
A、B、C分别是:A_______ B_________ C_____________
上述方案中,若首先仅仅将苯甲酸与其他三种物质分开,则应加入________。
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物中碳原子和氢原子个数比为3∶4,不能与溴水反应却能使KMnO4酸性溶液褪色。其蒸气密度是相同状况下甲烷密度的7.5倍。在铁存在时与溴反应,能生成两种一溴代物。该有机物可能是( )

查看答案和解析>>
科目:高中化学 来源: 题型:
请运用原电池原理设计实验,验证Cu2+、Fe3+氧化性的强弱。请写出电极反应式,负极________________________________________________________________________,
正极_____________________________________________________________________,
并在方框内画出实验装置图,要求用烧杯和盐桥,并标出外电路电子流向。
查看答案和解析>>
科目:高中化学 来源: 题型:
以甲烷燃料电池为例来分析在不同的环境下电极反应式的书写方法:
(1)酸性条件
燃料电池总反应式:CH4+2O2===CO2+2H2O ①
燃料电池正极反应式:O2+4H++4e-===2H2O ②
①-②×2,得燃料电池负极反应式:________________________________________
________________________________________________________________________。
(2)碱性条件
燃料电池总反应式:CH4+2O2+2NaOH===Na2CO3+3H2O ①
燃料电池正极反应式:O2+2H2O+4e-===4OH- ②
①-②×2,得燃料电池负极反应式:_______________________________________
________________________________________________________________________。
(3)固体电解质(高温下能传导O2-)
燃料电池总反应式:CH4+2O2===CO2+2H2O ①
燃料电池正极反应式:O2+4e-===2O2- ②
①-②×2,得燃料电池负极反应式:______________________________________
________________________________________________________________________。 (4)熔融碳酸盐(如:熔融K2CO3)环境下
电池总反应式:CH4+2O2===CO2+2H2O ①
正极电极反应式:O2+2CO2+4e-===2CO ②
②
①-②×2,得燃料电池负极反应式:_______________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
燃料电池能有效提高能源利用率,具有广泛的应用前景。下列物质均可用作燃料电池的燃料,其中最环保的是 ( )
A.甲醇 B.天然气
C.液化石油气 D.氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应没有涉及原电池的是 ( )
A.生铁投入稀盐酸中
B.铜片与银片用导线连接后,同时插入FeCl3溶液中
C.纯锌投入硫酸铜溶液中
D.含铜的铝片投入浓硫酸中
查看答案和解析>>
科目:高中化学 来源: 题型:
N2H4是一种高效清洁的火箭燃料。0.25 mol N2H4(g)完全燃烧生成氮气和气态水时,放出133.5 kJ热量。则下列热化学方程式中正确的是
A. N2H4+
N2H4+ O2===
O2=== N2+H2O ΔH=-267 kJ·mol-1
N2+H2O ΔH=-267 kJ·mol-1
B.N2H4(g)+O2(g)===N2(g)+2H2O(l) ΔH=-133.5 kJ·mol-1
C.N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=+534 kJ
D.N2H4(g)+O2(g)===N2(g)+2H2O(g) ΔH=-534 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
设NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,2.24L苯中含有的C-H键的数目为0.6NA
B.标准状况下,由H2O2分解制得4.48LO2转移的电子数目为0.8NA
C.14 g 由乙烯与环丙烷(C3H6)组成的混合气体含有的碳原子数目为NA
D.常温下,1 L pH=2的H2SO4溶液中含有的H+数目为0.02NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com