
| A. | 2.0 mol/L | B. | 1.5 mol/L | C. | 1.0 mol/L | D. | 0.5 mol/L |
分析 石墨作电极电解此溶液,当通电一段时间后,阳极上收集到22.4L(标准状况)气体时,阴极才开始产生气体,则阴极发生Cu2++2e-═Cu、2H++2e-═H2↑,阳极发生4OH--4e-═O2↑+2H2O,n(O2)=1mol,结合电子守恒及硫酸根离子守恒来解答.
解答 解:石墨作电极电解此溶液,当通电一段时间后,阳极上收集到22.4L(标准状况)气体时,阴极才开始产生气体,则阴极发生Cu2++2e-═Cu、2H++2e-═H2↑,阳极发生4OH--4e-═O2↑+2H2O,n(O2)=1mol,n(O2)=$\frac{22.4L}{22.4L/mol}$=1mol,阳极转移电子4mol,阴极发生的电极反应为:Cu2++2e-═Cu、2H++2e-═H2↑,此时转移4mol电子,铜离子放电完毕,所以铜离子的物质的量是2mol,CuSO4浓度是2mol/L,根据硫酸根守恒,所以K2SO4的浓度是0.5mol/L,钾离子浓度是1.0mol/L.
故选C.
点评 本题考查电解原理,明确发生的电极反应及电子守恒是解答本题的关键,题目难度中等.


 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案科目:高中化学 来源: 题型:选择题
| 化学键 | A-A | B-B | A-B |
| 生成1mol化学键时放出的能量 | 436kJ•mol-1 | 243kJ•mol-1 | 431kJ•mol-1 |
| A. | $\frac{1}{2}$A2(g)+$\frac{1}{2}$B2(g)═AB(g)△H=-91.5 kJ•mol -1 | |
| B. | A2(g)+B2(g)═2AB(g)△H=-183 kJ•mol -1 | |
| C. | $\frac{1}{2}$A2(g)+$\frac{1}{2}$B2═AB(g)△H=+91.5 kJ•mol-1 | |
| D. | 2AB(g)═A2(g)+B2(g)△H=+183 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 消耗相同浓度的盐酸一样多 | |
| B. | 消耗同浓度的盐酸后者多 | |
| C. | 与盐酸反应后相同条件下收集的气体一样多(不包括加热生成的) | |
| D. | 与盐酸反应后相同条件下收集的气体后者多.(不包括加热生成的) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 起始浓度 | 甲 | 乙 | 丙 |
| c(H2)/mol/L | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol/L | 0.010 | 0.010 | 0.020 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
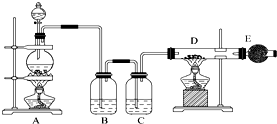 吸收尾气中未反应的氯气和防止空气中水蒸气进入装置D.
吸收尾气中未反应的氯气和防止空气中水蒸气进入装置D.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑥ | B. | ①②③ | C. | ①②⑤⑥ | D. | ①②③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MnO4-→MnO2 | B. | Cl2→HClO | C. | Fe2+→Fe3+ | D. | HCO3-→CO${\;}_{3}^{2-}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com