
(12分)某科研小组在900℃的空气中合成出化学式为La2Ca2MnOx的超导体材料,其中La以+3价存在。为确定x的值,进行如下分析:
步骤1:准确称取0.5250g超导体材料样品,放入锥形瓶中,加25.00mL0.06000mol?L-1Na2C2O4溶液(过量)和25mL6mol?L-1HNO3溶液,在60-70℃下充分摇动,约半小时后得到无色透明溶液A(该条件下,只有Mn元素被还原为Mn2+,Na2C2O4被氧化为CO2)。
步骤2:用0.02000mol?L-1KMnO4溶液滴定溶液A至终点,消耗10.00mL KMnO4溶液。
(1)步骤1反应后溶液中Mn2+的物质的量浓度为0.02000mol?L-1。常温下,为防止Mn2+形成Mn(OH)2沉淀,溶液的pH的范围为 [已知Mn(OH)2的Ksp=2.0×10-13]
(2)步骤2滴定终点的现象是 。
(3)步骤2滴定终点读数时俯视刻度,其他操作都正确,则所测x的值将 (填“偏大”、“偏小”或“不变”)。
(4)求x的值(写出计算过程)。
(12分)(1)pH≤8.5(2分);(2)溶液变成浅红色,且半分钟内不褪色(2分);(3)偏大(2分)
(4)样品溶解后,滴定消耗高锰酸钾:n(KMnO4)=0.01L×0.02000 mol·L-1=2.0×10-4mol(1分)
2MnO4-+ 5C2O42-+ 16H+=2Mn2++10CO2↑+8H2O
2.0×10-4mol 5.0×10-4mol (1分)
样品溶解过程所消耗的C2O42-的物质的量是:
0.025L×0.06000 mol/L—5.0×10-4mol=1.0×10-4mol (1分)
La2Ca2MnOx中Mn的化合价为(2x-10)(1分)
La2Ca2MnOx中锰得电子数与C2O42-失电子数相等:
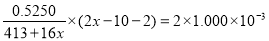 ,解得:x=7(2分)
,解得:x=7(2分)
【解析】
试题分析:(1)c(Mn2+)·c2(OH-)=Ksp (Mn(OH)2)=2.0×10-13; c2(OH-)=2.0×10-13÷0.02=1.0×10-11. c(OH-)=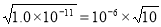 ,c(H+)=
,c(H+)=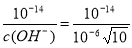 ,所以pH=8.5; (2)步骤2中用酸性KMnO4溶液滴定滴定Na2C2O4溶液时,若二者恰好完全反应,会看到溶液由无色变成浅红色,且半分钟内不褪色。即终点的现象是变成浅红色,且半分钟内不褪色;(3)步骤2滴定终点读数时俯视刻度,其他操作都正确,则酸性KMnO4溶液标准溶液的体积偏小,样品溶解过程所消耗的C2O42-量就偏大,所测x的值将偏大;(4) 样品溶解后,滴定消耗高锰酸钾溶液的物质的量是n(KMnO4)= 0.01L×0.02000 mol·L-1=2.0×10-4mol;Na2C2O4与酸性KMnO4溶液反应的离子方程式是:2MnO4-+5C2O42-+ 16H+=2Mn2++10CO2↑+8H2O,则根据离子方程式可知酸性KMnO4溶液反应消耗Na2C2O4的物质的量是n(C2O42-)=5/2 n(KMnO4)= 5.0×10-4mol;则样品溶解过程所消耗的C2O42-的物质的量是:n(C2O42-)= 0.025L×0.06000 mol/L—5.0×10-4mol=1.0×10-4mol;在La2Ca2MnOx中Mn的化合价为(2x-10),La2Ca2MnOx中锰得电子数与C2O42-失电子数相等,所以
,所以pH=8.5; (2)步骤2中用酸性KMnO4溶液滴定滴定Na2C2O4溶液时,若二者恰好完全反应,会看到溶液由无色变成浅红色,且半分钟内不褪色。即终点的现象是变成浅红色,且半分钟内不褪色;(3)步骤2滴定终点读数时俯视刻度,其他操作都正确,则酸性KMnO4溶液标准溶液的体积偏小,样品溶解过程所消耗的C2O42-量就偏大,所测x的值将偏大;(4) 样品溶解后,滴定消耗高锰酸钾溶液的物质的量是n(KMnO4)= 0.01L×0.02000 mol·L-1=2.0×10-4mol;Na2C2O4与酸性KMnO4溶液反应的离子方程式是:2MnO4-+5C2O42-+ 16H+=2Mn2++10CO2↑+8H2O,则根据离子方程式可知酸性KMnO4溶液反应消耗Na2C2O4的物质的量是n(C2O42-)=5/2 n(KMnO4)= 5.0×10-4mol;则样品溶解过程所消耗的C2O42-的物质的量是:n(C2O42-)= 0.025L×0.06000 mol/L—5.0×10-4mol=1.0×10-4mol;在La2Ca2MnOx中Mn的化合价为(2x-10),La2Ca2MnOx中锰得电子数与C2O42-失电子数相等,所以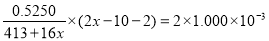 ,解得x=7。
,解得x=7。
考点:考查溶液pH的计算、滴定终点的判断、守恒方法、滴定方法在物质化学式确定中的应用的知识。


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:单选题
化学与社会、生活紧密相连。下列说法合理的是
| A.节日期间,在人群密集处燃放烟花爆竹 |
| B.寻找一种高效催化剂将水直接变成汽油 |
| C.炒菜时油锅中的油不慎着火,迅速盖上锅盖 |
| D.用点燃的火柴在液化气钢瓶口检验是否漏气 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列关于油脂的有关知识,说法不正确的是
| A.油脂都不能使溴水或酸性高锰酸钾溶液褪色 |
| B.油脂的饱和程度对油脂的熔点有着重要的影响 |
| C.油脂属于酯类物质 |
| D.食用油放在玻璃瓶中比放在塑料瓶中保存更科学 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
绿色化学的核心是反应过程的绿色化,即要求原料物质中的所有原子完全被利用且全部转入期望的产品中,下列过程不符合这一思想的的是
A.甲烷、CO合成乙酸乙酯:2CH4+2CO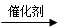 CH3COOCH2CH3 CH3COOCH2CH3 |
B.烯烃与水煤气发生的羰基合成反应:RCH=CH2+CO+ H2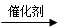 RCH2CH2CHO RCH2CH2CHO |
C.甲烷与氯气反应制氯仿:CH4+3Cl2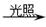 CHCl3+3HCl CHCl3+3HCl |
| D.乙烯合成聚乙烯 |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省高三上学期期中考试化学试卷(解析版) 题型:选择题
下列依据相关实验或事实得出的结论正确的是
A.SiO2既能与HF溶液反应,又能与NaOH溶液反应,说明SiO2是两性氧化物
B.鸡蛋清溶液中加入饱和(NH4)2SO4溶液有白色沉淀产生,说明蛋白质发生了变性
C.将少量某有机物滴加到新制氢氧化铜中,充分振荡,未见砖红色沉淀生成,说明该有机物不含醛基
D.相同体积pH均为3的HA和HB两种酸分别与足量的锌充分反应,HA放出的氢气多,说明HB的酸性比HA的酸性强
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省高三上学期期中考试化学试卷(解析版) 题型:选择题
下列有关实验原理、操作或现象不正确的是
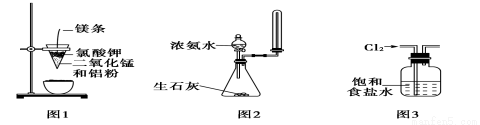
A.图1装置可制得金属锰,用同样的装置可制得金属铬
B.实验室用图2所示装置制取少量氨气
C.实验室用图3所示装置除去Cl2中的少量HCl
D.用一束光照射淀粉溶液会产生一条明显的光路
查看答案和解析>>
科目:高中化学 来源:2014-2015陕西省宝鸡市高二上学期期末化学试卷(解析版) 题型:选择题
下列对于淀粉和纤维素的叙述中,正确的是
A.互为同分异构体 B.都是纯净物,化学性质完全相同
C.碳、氢、氧元素的质量比完全相同 D.结构相同
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省潍坊市高一上学期1月月考化学试卷(解析版) 题型:填空题
(本题7个空,每空2分,共14分)
(1)9.5g MgCl2溶于水配成100mL溶液,所得溶液的物质的量浓度为 ,取溶液25.0mL,稀释到500mL,此时溶液中Cl-的物质的量浓度为 ,在这两个实验中除了用烧杯、量筒、胶头滴管外,还需用到的玻璃仪器是 。
(2)在反应3Cl2 + 6KOH(浓) == 5KCl + KClO3 + 3H2O中,氧化产物与还原产物的物质的量之比为 ,3molCl2参加该反应时,反应中转移 mol电子。
(3)氧化还原反应中实际上包含氧化和还原两个过程。下面是一个还原过程的反应式:NO3- +4H++3e- = NO↑+2H2O。KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
①写出该氧化还原反应的化学方程式(不需要配平): 。
②反应中硝酸体现了 的性质。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com