
| A. | 分子中只存在极性键 | B. | 在氰气中N、C的化合价为0 | ||
| C. | CN的电子式: | D. | 能与烯烃发生加成反应 |
分析 A.氰气(CN)2结构为N≡C-C≡N,存在碳碳非极性键;
B.根据在化合物中正负化合价代数和为零,结合氰气的结构进行解答;
C.CN-中碳原子满足8电子稳定结构;
D.含有不饱和键,可发生加成反应.
解答 解:A.氰气(CN)2结构为N≡C-C≡N,存在碳氮极性键和碳碳非极性键,故A错误;
B.氰气的结构为N≡C-C≡N,在氰气中N、C的化合价分别为-3、+3,故B错误;
C.CN-电子式为 ,故C错误;
,故C错误;
D.氰气(CN)2结构为N≡C-C≡N,含有不饱和键,可发生加成反应,故D正确;
故选D.
点评 本题考查了物质的组成、结构和性质的关系,涉及电子式的书写等知识,题目难度不大,可以根据已知的乙炔的结构、卤素的性质结合元素周期律来分析解答,试题有利于培养学生的知识迁移能力.


科目:高中化学 来源: 题型:选择题
| A. | 单质氧化性的强弱 | |
| B. | 单质沸点的高低 | |
| C. | 单质与氢气化合的难易 | |
| D. | 最高价氧化物对应的水化物酸性的强弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (CH3COO)2Pb+H2S→PbS↓+2CH3COOH | |
| B. | Pb2++2CH3COO-+H2S→PbS↓+2CH3COOH | |
| C. | Pb2++H2S→PbS↓+2H+ | |
| D. | Pb2++2CH3COO-+2H++S2-→PbS↓+2CH3COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量多 | |
| B. | 由C(金刚石)→C(石墨)+119KJ 可知,金刚石比石墨稳定 | |
| C. | 在101Kpa时,2gH2完全燃烧生成液态水,放出285.8KJ热量,氢气燃烧的热化学方程式为:2H2(g)+O2(g)→2H2O(l)+285.8KJ | |
| D. | 在稀溶液中:H+(aq)+OH-(aq)→H2O(l)+53.7KJ,若将含0.5 molH2SO4的浓溶液与含1 molNaOH的溶液混合,放出的热量大于53.7KJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验目的 | 实验方案 |
| A | 检验食盐中是否添加KIO3 | 取食盐试样,溶于KI溶液,加入淀淀溶液,观察溶液是否变蓝 |
| B | 验证硝酸是挥发性酸 | 用两根玻璃棒分别蘸取浓硝酸和浓氨水,然后靠近,观察是否有白烟产生 |
| C | 验证Br2氧化性强于Fe3+ | 取少许FeCl2晶体溶于稀盐酸,加入KSCN观察溶液是否变红,滴入溴水后再观察是否变红 |
| D | 检验氯酸钾中含有氯元素 | 取少量氯酸钾加入MnO2充分加热,残留物溶于水,取上层清液,滴入硝酸酸化的AgNO3溶液,观察是否有白色沉淀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北石家庄辛集中学高二上阶段考一化学卷(解析版) 题型:选择题
1 mol某烃在氧气中充分燃烧,需要消耗氧气179.2 L(标准状况)。它在光照的条件下与氯气反应能生成三种不同的一氯取代物。该烃的结构简式是( )
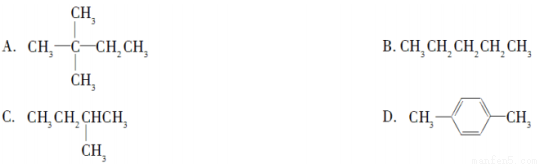
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO3溶液中:c(SO32-)<c(H2SO3) | |
| B. | 吸收过程中,始终存在着:c(Na+)+c(H+)=c(OH-)+2c(SO32-)+c(HSO3-) | |
| C. | 中性溶液中:c(Na+)>c(HSO3-)=c(SO32-)>c(OH-)=c(H+) | |
| D. | 中性溶液中:c(Na+)=c(SO32-)+c(HSO3-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
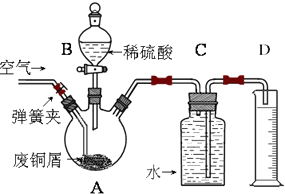 一学习小组利用下图所示装置,对某含少量Fe的废铜屑进行铜含量的测定,并探究利用其制备硫酸铜溶液.
一学习小组利用下图所示装置,对某含少量Fe的废铜屑进行铜含量的测定,并探究利用其制备硫酸铜溶液.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH溶液于水时仅破坏了离子键而未破坏共价键 | |
| B. | NH4Cl溶解于水时不仅破坏了离子键还破坏了共价键 | |
| C. | H2SO4溶解于水时,所有的共价键都被破坏 | |
| D. | HCl溶解于水时电离出H+和Cl-,所以共价键变成了离子键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com