
【题目】下列离子方程式正确的是( )
A.等体积、等浓度的Ba(OH)2稀溶液与NH4HCO3稀溶液混合:Ba2++2OH+NH4++HCO3=BaCO3↓+NH3·H2O+H2O
B.将磁性氧化铁溶于盐酸:Fe3O4+8H+=3Fe3++4H2O
C.用铁电极电解氯化钠溶液:2Cl+2H2O![]() 2OH+H2↑+Cl2↑
2OH+H2↑+Cl2↑
D.将SO2通入Ca(ClO)2溶液中:Ca2++2ClO+SO2+H2O=CaSO3↓+2HClO
【答案】A
【解析】
A.等体积等浓度的Ba(OH)2稀溶液与NH4HCO3稀溶液混合,离子方程式:Ba2++2OH+NH4++HCO3=BaCO3↓+NH3·H2O+H2O,选项A正确;
B.磁性氧化铁中Fe元素的化合价![]() 为+2价,
为+2价,![]() 为+3价。磁性氧化铁溶于盐酸的离子方程式:Fe3O4+8H+=2Fe3++ Fe2++4H2O,选项B错误;
为+3价。磁性氧化铁溶于盐酸的离子方程式:Fe3O4+8H+=2Fe3++ Fe2++4H2O,选项B错误;
C.惰性电极电解氯化镁溶液的离子反应方程式为Mg2++2Cl-+2H2O![]() Cl2↑+H2↑+Mg(OH)2↓,选项C错误;
Cl2↑+H2↑+Mg(OH)2↓,选项C错误;
D.将SO2通入Ca(ClO)2溶液中的离子反应方程式为Ca2++ClO-+SO2+H2O═CaSO4↓+2H++Cl-,选项D错误;
答案选A。


科目:高中化学 来源: 题型:
【题目】砷(As)是第四周期ⅤA族元素,可以形成As2S3、As2O5、H3AsO3、H3AsO4等化合物,有着广泛的用途。回答下列问题:
(1)画出砷的原子结构示意图:______________。
(2)工业上常将含砷废渣(主要成分为As2S3)制成浆状,通入O2氧化,生成H3AsO4和单质硫。写出发生反应的化学方程式:__________________________。
(3)已知:As(s)+![]() H2(g)+2O2(g)=H3AsO4(s) ΔH1;H2(g)+
H2(g)+2O2(g)=H3AsO4(s) ΔH1;H2(g)+![]() O2(g)=H2O(l) ΔH2;2As(s)+
O2(g)=H2O(l) ΔH2;2As(s)+![]() O2(g)=As2O5(s) ΔH3。则反应As2O5(s)+3H2O(l)=2H3AsO4(s)的ΔH=________________________。
O2(g)=As2O5(s) ΔH3。则反应As2O5(s)+3H2O(l)=2H3AsO4(s)的ΔH=________________________。
(4)298 K时,将20mL 3x mol·L-1Na2AsO3、20mL 3x mol·L-1 I2和20mL NaOH溶液混合,发生反应:AsO33- (aq)+I2(aq)+2OH-(aq)=AsO43- (aq)+2I-(aq)+H2O(l)。溶液中c(AsO43- )与反应时间(t)的关系如图所示。

①下列可判断反应达到平衡的是________(填选项字母)。
a.溶液的pH不再变化 b.v(I-)=2v(AsO33-)
c.![]() 不再变化 d.c(I-)=y mol·L-1
不再变化 d.c(I-)=y mol·L-1
②tm时,v正______v逆(填“大于”“小于”或“等于”)。
③tm时的v逆____tn时的v逆(填“大于”“小于”或“等于”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、L、M五种元素的原子序数依次增大,X的阴离子与Y的内层电子数相等,Y原子的最外层电子数是次外层电子数的两倍,Z、L是空气中含量最多的两种元素,M是地壳中含量最高的金属元素。回答下列问题:
(1)X与L形成的常见阴离子的电子式为____________________。
(2)Z、X两元素按原子数目比1:3和2:4构成分子A和B,用电子式表示A的形成过程______,B的结构式_______________________。
(3)硒是人体必须的微量元素,与L同一主族,硒原子比L原子多两个电子层,则硒在周期表的位置为_______________,其最高价氧化物水化物的化学式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号为___,该能层具有的原子轨道数为___。
(2)BF3与一定量的水形成(H2O)2BF3晶体Q,Q在一定条件下可转化为R:

晶体Q中各种微粒间的作用力有______(填序号)。
a.离子键 b.共价键 c.配位键 d.氢键
(3)第一电离能I1(Zn)___I1(Cu)(填“大于”或“小于”),原因是______。
(4)Ti晶体的原子堆积方式为六方堆积(如图所示),则晶体中Ti原子的配位数是___,某Ti配合物的化学式是[Ti (H2O)5Cl]Cl2·H2O,1 mol该配合物中含配位键的数目是___。
![]()
(5)石墨烯(如图a)是一种由单层碳原子构成的平面结构新型碳材料,石墨烯中部分碳原子被氧化后,其平面结构会发生改变,转化为氧化石墨烯(如图b)。

图a中,1号C与相邻C形成σ键的个数为____,图b中键角α___键角β。(填“>”、“<”或“=” );若将图b所示的氧化石墨烯分散在H2O中,则氧化石墨烯中可与H2O形成氢键的原子有_____(填元素符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含硼、氮、磷、铜、锌的化合物有许多重要用途。回答下列问题:
(1)基态B原子电子占据最高能级的电子云轮廓图为____;基态Cu+的核外电子排布式为___。
(2)化合物(CH3)3N能溶于水的原因是______。
(3)亚磷酸(H3PO3)是磷元素的一种含氧酸,与NaOH反应只生成NaH2PO3和Na2HPO3两种盐,则H3PO3分子的结构式为____。
(4)Zn2+可与CN-、二苯硫腙(![]() )等形成稳定配合物。
)等形成稳定配合物。
①CN- 的结构式为_____。
②每个二苯硫腙分子中,采取sp2杂化的原子有__个。
(5)卤化锌的熔点如表所示:
ZnF2 | ZnCl2 | ZnBr2 | ZnI2 | |
熔点/℃ | 872 | 275 | 394 | 446 |
ZnF2的熔点远高于其它三种卤化锌,其原因为_____。
(6)磷化硼是一种耐磨涂料,它可用作金属的表面保护层。磷化硼晶体晶胞如图1所示:
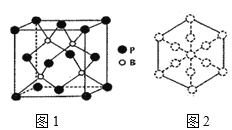
①磷化硼晶胞沿着体对角线方向的投影如图2,请在答题卡上将表示B原子的圆圈涂黑____。
②已知磷化硼晶体的密度为ρ g/cm3,阿伏加德罗常数为NA,则B—P键长为___pm(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图的转化关系判断下列说法正确的是(反应条件已略去)( )
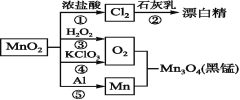
A.反应①②③④⑤均属于氧化还原反应,反应③还属于置换反应
B.反应⑤说明该条件下铝可用于制熔点较高的金属
C.相同条件下生成等量的O2,反应③和④转移的电子数之比为1∶1
D.反应①中氧化剂与还原剂的物质的量之比为1∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下反应①NH3+H+![]() NH
NH![]() (平衡常数为K1),②Ag++Cl-
(平衡常数为K1),②Ag++Cl-![]() AgCl(平衡常数为K2),③Ag++2NH3
AgCl(平衡常数为K2),③Ag++2NH3![]() Ag(NH3)
Ag(NH3)![]() (平衡常数为K3)。
(平衡常数为K3)。
①、②、③的平衡常数关系为K1>K3>K2,据此所做的以下推测合理的是
A.氯化银不溶于氨水
B.银氨溶液中加入少量氯化钠有白色沉淀
C.银氨溶液中加入盐酸有白色沉淀
D.银氨溶液可在酸性条件下稳定存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂对制革工业污泥中Cr元素的回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Fe2+、Al3+、Ca2+、Mg2+):

常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | - | - | 4.7 | - |
沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9(>9溶解) |
(1)酸浸时,为了提高浸取率可采取的措施是___(写一条即可)。
(2)调pH=8是为了除去___(填Fe3+、Al3+、Ca2+、Mg2+)。
(3)试配平氧化还原反应方程式:_Na2Cr2O7+_SO2+_H2O=________Cr(OH)(H2O)5SO4+_Na2SO4;每生成1molCr(OH)(H2O)5SO4消耗SO2的物质的量为___。
(4)印刷电路铜板腐蚀剂常用FeCl3。腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol/L,请参照上表给出的数据和提供的药品,简述除去CuCl2溶液中Fe3+ 和Fe2+的实验步骤:①___;②___;③过滤。(提供的药品:Cl2、浓H2SO4、NaOH溶液、CuO、Cu)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】17.4g MnO2与240 mL 10 mol/L(密度为1.10g/mL)的盐酸(足量)混合加热(不考虑盐酸挥发),使其充分反应后,再向溶液中加入足量的AgNO3溶液。(已知:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O)
MnCl2+Cl2↑+2H2O)
试求:(1)10 mol/L的盐酸的质量分数____________
(2)产生的气体在标准状况下的体积______________;
(3)产生沉淀的质量_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com