
下图是实验室制取氯水及干燥纯净氯气的实验装置.
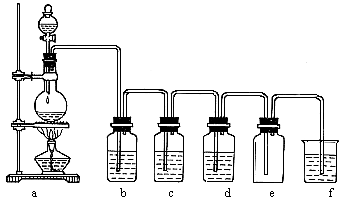
试回答下列各问:
(1)若用浓盐酸跟二氧化锰起反应来制取氯气.补充下列实验步骤,直到反应开始进行:
①按图示那样把装置连接好,并且检查气密性.
______________________________________________________________
______________________________________________________________
______________________________________________________________
(2)写出a装置中发生反应的化学方程式,标出电子转移的情况:
______________________________________________________________
(3)若制取两瓶氯水,这两瓶是________,现象是________.
(4)d装置中盛放的是________,它的作用是________.
(5)e装置用于收集氯气,所收集的氯气中________(填含有或不含)氯化氢,试说明理由:________.
(6)f装置中盛放的是________溶液,它的作用是________.
 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案科目:高中化学 来源: 题型:阅读理解

| ||
| ||
| ||
. |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 .
.
| 3b |
| 4 |
| 3b |
| 4 |
| 实验步骤 | 操作 | 现象与结论 |
| 第一步 | 取少量液体装于试管,向试管中滴入几滴KSCN溶液 | |
| 第二步 | 若溶液紫色退去,则说明含有Fe2+, 若无明显变化,则说明不含Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 实验 序号 |
实验操作 | 现象 | 结论 |
| Ⅰ | 将氯水滴入品红溶液 | 品红溶液褪色 | 氯气与水反应的产物有漂白性 |
| Ⅱ | 氯水中加入碳酸氢钠粉末 | 有无色气 泡产生 |
氯气与水反应的产物具有酸性 |
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com