
| A. | ①②③ | B. | ②④⑥ | C. | ①⑤⑥ | D. | ①②⑥ |
分析 ①天然气的主要成分为甲烷,可在光照条件下发生取代反应;
②乙烯的产量是衡量一个国家石油化工发展水平的标志,含碳碳双键发生加成反应;
③苯中不含碳碳双键;
④乙醇、水均与Na反应;
⑤淀粉为多糖,遇碘单质变蓝色;
⑥蛋白质灼烧有烧焦的特殊气味,含-CONH-,水解的最终产物为氨基酸.
解答 解:①天然气的主要成分为甲烷,可在光照条件下发生取代反应生成卤代烃,故正确;
②乙烯的产量是衡量一个国家石油化工发展水平的标志,含碳碳双键发生加成反应,故正确;
③苯中不含碳碳双键,苯中化学键为介于单键、双键之间特殊的化学键,故错误;
④乙醇、水均与Na反应,不能检验,应利用无水硫酸铜检验水,故错误;
⑤淀粉为多糖,遇碘单质变蓝色,而不是碘元素,故错误;
⑥蛋白质灼烧有烧焦羽毛的气味,可通过烧焦的特殊气味进行鉴别,含-CONH-,水解的最终产物为氨基酸,故正确;
故选D.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意组成、性质及有机反应的应用,题目难度不大.


 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入Al粉放出H2的溶液中:Na+、K+、Fe3+、NO3- | |
| B. | 含有SCN-离子的溶液中:Ca2+、Fe2+、NO3-、Cl- | |
| C. | 水电离出的c(H+)=1×10-13mol/L的溶液中:Mg2+、K+、NO3-、Cl- | |
| D. | c(Fe3+)=0.1mol/L的溶液中:NH4+、Cl-、AlO2-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
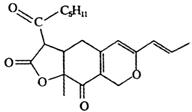
| A. | 该物质的分子式为C21H25O5 | |
| B. | 该物质含有四种含氧官能团 | |
| C. | 1 mol该物质在一定条件下最多可以和5mol H2反应 | |
| D. | 1 mol该物质最多能与2 mol NaOH反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2LBr2通入足量的NaOH溶液中生成NaBr和NaBrO,则转移电子数为0.5NA | |
| B. | 5.6gFe溶于1L0.3moL/L硝酸中,转移的电子数为0,3NA | |
| C. | 足量的Zn与浓硫酸共热可生成标准状况下的气体2.24L,则参加反应的硫酸为0.4NA | |
| D. | 标准状况下,11.2LN2和H2的混合气体中所含原子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol12C原子的质量是12g,1个12C原子的质量是$\frac{12}{{N}_{A}}$g | |
| B. | 在常温常压下,11.2L N2含有分子数为0.5NA | |
| C. | 18 g水所含有的氢原子数目为2NA,氧原子数目为NA | |
| D. | 1L 0.1mol•L-1 Na2SO4溶液中,Na+和SO${\;}_{4}^{2-}$的离子总数是0.3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇是重要的化工原料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
甲醇是重要的化工原料.利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com