
分析 一定量的CO2气体由标准状况变到常温常压时,则是升高温度,压强不变的过程,根据气体状态方程PV=nRT,结合有关物质的量的公式来判断.
解答 解:一定量的CO2气体由标准状况变到常温常压时,则是升高温度,压强不变的过程,物质的量不变,根据气体状态方程PV=nRT,所以体积增大,摩尔质量、式量不收温度压强的影响,都不变,m=nM,所以质量不变,粒子个数N=nNA不变,密度等于质量和体积的比值,质量不变,体积增大,所以密度减小,所以变化的量是⑥⑦,不变的量是①②③④⑤.
答:变量是⑥⑦,不变的量是:①②③④⑤.
点评 本题考查学生物理量的意义以及有关物质的量的公式的灵活应用等,注意各个物理量的内涵是关键,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 得到2.54 g沉淀时,加入NaOH溶液的体积是600 mL | |
| B. | 该浓硝酸中HNO3的物质的量浓度是14.0 mol•L-1 | |
| C. | 该合金中铜与镁的物质的量之比是2:1 | |
| D. | NO2和N2O4的混合气体中,NO2的体积分数是80% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器编号 | 起始时各物质物质的量/mol | 平衡时反应中的能量变化 | ||
| A | B | C | ||
| (1) | 1 | 3 | 0 | 放出热量a kJ |
| (2) | 0 | 0 | 2 | 吸收热量b kJ |
| (3) | 2 | 6 | 0 | 放出热量c kJ |
| A. | A的体积分数:(2)>(1)>(3) | |
| B. | 三个容器内反应的平衡常数:K(3)=K2(1)=K2(2) | |
| C. | 达平衡时体系压强:P(3)=2P(1) | |
| D. | 热量关系:a+b=50 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
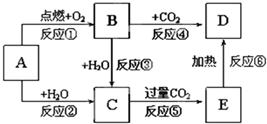
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 物理变化、化学变化 | B. | 氧化还原反应、分复反应 | ||
| C. | 氧化还原反应、化合反应 | D. | 分解反应、复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 100mL | B. | 40mL | C. | 25mL | D. | 20mL |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Al3+ | 3.0 | 5.0 |
| Fe2+ | 5.8 | 8.8 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com