
【题目】硼酸和硫酸镁是重要的化工原料。以硼铁混精矿[主要成分为MgBO2(OH)、UO2和Fe3O4,还有少量的Fe2O3、FeO、SiO2]为原料制备硼酸和硫酸镁的工艺流程如下:
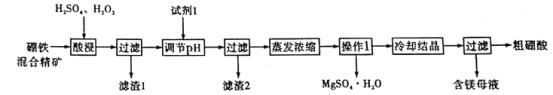
已知:①UO22+在pH为4-5的溶液中生成UO2(OH)2沉淀;②Fe2+和Fe3+沉淀完全的pH分别为9.7、3.7。
(1)酸浸过程中MgBO2(OH)与硫酸反应的离子方程式为_____。
(2)酸浸过程中加入H2O2的目的是______(写出两条),滤渣1的主要成分是___(填化学式)。
(3)试剂1最好选择_____(填化学式)。若调节溶液pH前,溶液中c(Mg2+)=0.2 mol/L,当溶液pH调至5时,UO2+沉淀完全,此时是否有Mg(OH)2沉淀生成____。{通过计算说明,Ksp[Mg(OH)2]=5.6×10-12}
(4)操作1的名称是_____。
(5)MgSO4·H2O加热脱水可以得无水MgSO4,那么MgCl2·6H2O晶体直接加热___(填“能”或“不能”)得到无水MgCl2,理由是_______。
(6)已知:H2CO3的Ka1=4.4×10-7,Ka2=4.7×10-11;H3BO3的Ka=5.8×10-10。向碳酸钠溶液里逐滴加入硼酸溶液____(填“有”或“无”)气泡产生,理由是____。
【答案】MgBO2(OH)+2H+=Mg2++H3BO3 将Fe2+氧化为Fe3+,将UO2氧化成UO22+便于后续过程除去 SiO2 MgO或者Mg(OH)2或者MgCO3 c(Mg2+)×c2(OH-)=0.2×(10-9)2=2×10-19<Ksp[Mg (OH) 2]=5.6×10-12,因此不会产生Mg (OH) 2沉淀 趁热过滤 不能 加热时促进了MgCl2的水解,最终得到氢氧化镁、氧化镁或碱式碳酸镁 无 硼酸的酸性比碳酸弱
【解析】
用硫酸酸化的H2O2溶解硼铁混精矿,其中SiO2不溶于水和酸,经过滤可除去,所得滤液中主要含有UO22+、Fe3+、Mg2+及H3BO3,用MgO或者Mg(OH)2或者MgCO3调节溶液pH,使溶液中Fe3+完全转化为Fe(OH)3沉淀,并经过滤得滤渣2,将滤液蒸发、浓缩,趁热过滤,获得MgSO4·H2O晶体析出,将滤液冷却结晶,过滤可得粗硼酸,据此分析解题。
(1)酸浸过程中MgBO2(OH)与硫酸反应,生成硼酸和硫酸镁,发生反应的离子方程式为MgBO2(OH)+2H+=Mg2++H3BO3;
(2)酸浸过程中加入H2O2,利用H2O2的氧化性,将Fe2+氧化为Fe3+,同时将UO2氧化成UO22+便于后续过程除去;SiO2不溶于水和酸,则滤渣1的主要成分是SiO2;
(3)添加试剂1是调节溶液pH,则试剂1能与酸反应,且不引入新的杂质,故最好选择MgO或者Mg(OH)2或者MgCO3;c(Mg2+)=0.2 mol/L,当溶液pH调至5时,c(OH-)=1×10-9mol/L,则c(Mg2+)×c2(OH-)=0.2×(10-9)2=2×10-19<Ksp[Mg (OH) 2]=5.6×10-12,因此不会产生Mg (OH) 2沉淀。
(4)结合以上分析可知,将滤液蒸发、浓缩,趁热过滤,获得MgSO4·H2O晶体析出,所以操作1的名称是趁热过滤;
(5)MgCl2能水解生成Mg (OH) 2和HCl,MgCl2·6H2O晶体直接加热时,促进Mg2+水解,且HCl挥发,则最终得到氢氧化镁、氧化镁或碱式碳酸镁,而不能得到无水MgCl2;
(6)已知:H2CO3的Ka1=4.4×10-7,Ka2=4.7×10-11;H3BO3的Ka=5.8×10-10,则硼酸的酸性介于H2CO3和HCO3-之间,根据强酸制弱酸的原理,向碳酸钠溶液里逐滴加入硼酸溶液只能生成NaHCO3和NaBO3,无碳酸生成,即无气泡产生。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】乙炔是重要的有机化工原料,其化学性质活泼。完成下列填空
(1)乙炔能使溴水褪色,说明乙炔能发生__________ 反应(填反应类型);乙炔能使酸性高锰酸钾褪色,说明乙炔容易被_____________。
(2)乙炔在一定条件下三聚得到CH2=CH—C≡C—CH=CH2,写出与该三聚物具有相同化学式且不易发生加成反应的物质的结构简式 :___________________________。
(3)写出苯与液溴反应的方程式:________________________________________。
(4)鉴别苯和二乙烯基乙炔(CH2=CH—C≡C—CH=CH2)可用的试剂_________________________。
(5)乙炔聚合得到聚乙炔,聚乙炔_________导电(选填“能”或“不能”)。
(6)乙炔在不同的催化条件下加氢可得到不同的产物。下列物质与乙炔加氢得到的某种产物互为同系物的是________________(选填编号)。
a.C2H4 b.C2H6 c.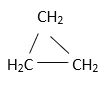 d.CH2=CHCH3
d.CH2=CHCH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用1.0mol·L -1NaOH溶液中和某浓度硫酸溶液时,其pH和所加NaOH溶液的体积(V)关系如右图所示,则原硫酸溶液的物质的量浓度和恰好完全反应后溶液的总体积分别是(设二者混合后体积为二者体积之和)
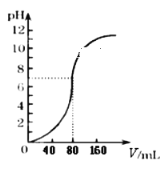
A. 0.5mol·L-1 80mLB. 0.5mol·L-1 160mL
C. 1.0mol·L-1 80mLD. 1.0mol·L-1 160mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向c(H+)=1×10-6mol·L-1的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液中c(H+)=1×10-3mol·L-1。下列对该溶液的叙述不正确的是( )
A.该温度高于25℃
B.![]() 的电离方程式为NaHSO4=Na++H++SO42-
的电离方程式为NaHSO4=Na++H++SO42-
C.加入NaHSO4晶体抑制了水的电离
D.由水电离出来的H+的浓度为1×10-12mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸铜溶液可用于浸取硫铁矿中的铁,浸取时发生复杂的氧化还原反应,反应体系中除![]() 和
和![]() 外,还有
外,还有![]() 、
、![]() 、
、![]() 和
和![]() ,下列对该反应的分析不正确的是( )
,下列对该反应的分析不正确的是( )
A.氧化剂为![]() 和
和![]()
B.反应后溶液的pH降低
C.每转移2 mol电子消耗3 mol ![]()
D.被氧化的![]() 只占总量的30%
只占总量的30%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应不属于氧化还原反应的是
A. AgNO3+NaCl===AgCl↓+NaNO3 B. 3CO+Fe2O3![]() 2Fe+3CO2
2Fe+3CO2
C. 2F2+2H2O===4HF+O2 D. MgCl2(熔融) ![]() Mg+Cl2↑
Mg+Cl2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2是实验室常见的强氧化剂,在医疗上可用作消毒剂等。
(1)一种正在开发的利用O2和H2O作原料通过化合制取H2O2的方法,其原理如图所示。该方法制取H2O2的总化学反应方程式为____。
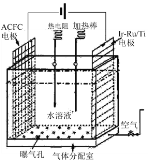
(2)为探究外界条件对H2O2分解化学反应速率的影响,相关实验设计如下表所示:
试管 编号 | 实验目的 | H2O2溶液 | 温度 | 水的 体积/mL | FeCl3溶液体积/mL | |
质量 分数 | 体积/mL | |||||
Ⅰ | 为编号Ⅱ实验参照 | 12% | 5.0 | 常温 | 0 | 0 |
Ⅱ | 温度对反应速率的影响 | ( ) | 5.0 | 60℃ | 0 | 0 |
Ⅲ | 为编号Ⅳ实验参照 | 4.0% | 5.0 | 常温 | ( ) | 0 |
Ⅳ | ( ) | 4.0% | 5.0 | 常温 | 0 | 1.0 |
填写表中缺少的内容:Ⅱ_______;Ⅲ__________;Ⅳ_________。
(3)由铂(Pt位于左边)和金(Au位于右边)组成的纳米棒放入H2O2溶液中(如图),纳米棒将发生定向移动。
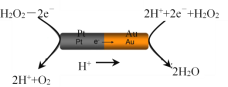
则:Au一侧为电池的____极(选填:“正”或“负”);纳米棒向____(选填:“左”或“右”)移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(其密度为1.84g·cm-3)配制250mL0.4mol·L-1稀硫酸,有以下实验仪器供选:
A.10mL量筒 B.托盘天平 C.玻璃棒 D.250mL容量瓶 E.500mL容量瓶 F.胶头滴管 G.烧杯
(1)需量取浓硫酸的体积为___mL。
(2)实验时不可选用的仪器有(填序号)___。
(3)配制过程中,下列情况会使配制结果偏高的是___(填序号)
①容量瓶使用时未干燥;
②定容时俯视刻度线观察液面;
③将浓硫酸在烧杯中稀释后未经冷却就转移至容量瓶中,并定容;
④定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线。
(4)配制过程中,实验操作步骤为:___
A.在烧杯中注入蒸馏水(溶液体积少于250mL),沿烧杯壁注入量取的浓硫酸用玻璃棒搅拌,使其混匀。
B.待稀释的硫酸冷却后,沿玻璃棒注入250mL的容量瓶中
C.用量筒量取密度为1.84g/cm3质量分数为98%的浓硫酸
D.用蒸馏水洗涤烧杯2~3次,将洗涤液注入容量瓶中。
E.往容量瓶中小心加蒸馏水至液面接近刻度1-2cm处,改用__加蒸馏水,使溶液凹液面恰好与刻度线相切。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组用下图装置研究SO2的性质。
| 序号 | X | 实验现象 |
Ⅰ | 紫色石蕊溶液 | 现象a | |
Ⅱ | 品红溶液 | 溶液由红色变为无色,加热后又恢复原来的颜色 | |
Ⅲ | 酸性KMnO4溶液 | 溶液由紫色变为无色 |
请回答:
(1)实验Ⅰ中,现象a是______。
(2)根据实验Ⅱ,推断SO2的化学性质是______。
(3)根据实验Ⅲ,推断无色溶液中所含的离子是K+、Mn2+、H+和______。
(4)结合离子方程式说明实验中NaOH溶液的作用是______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com