
| A. | 合成氨生产过程中将NH3液化分离,会降低反应速率,但可提高N2、H2的转化率 | |
| B. | 从海水提取镁的过程中,电解熔融的MgO制备Mg | |
| C. | 合成氨工业温度选择为450℃,主要是为了提高化学反应速率 | |
| D. | 电解饱和食盐水制烧碱时,应在阴极室加入饱和NaCl溶液 |
分析 A、减小生成物的浓度会导致化学反应速率减慢,化学平衡正向移动;
B、根据MgO比MgCl2熔点高,电解MgO比电解MgCl2的电能多分析;
C、450℃左右,催化剂的活性最大,合成氨为放热反应,温度太高转化率会减小;
D、电解饱和食盐水时,阴极室产生的是氢气和氢氧化钠,阳极上产生的是氯气.
解答 解:A、合成氨生产过程中将NH3液化分离,减小氨气的浓度会导致正化学反应速率减慢,化学平衡向右移动,提高N2、H2的转化率,故A正确;
B、MgO比MgCl2熔点高,电解MgO比电解MgCl2的电能多,浪费资源,所以工业上通过电解熔融氯化镁获得金属镁,故B错误;
C、450℃左右,催化剂的活性最大,反应速率最快,合成氨为放热反应温度太高转化率会减小,所以温度不能太高,合成氨工业温度选择为450℃,主要是催化剂的活性最大,故C错误;
D、电解饱和食盐水时,阴极室产生的是氢气和氢氧化钠,阳极上产生的是氯气,所以在阳极室加入饱和NaCl溶液,故D错误;
故选A.
点评 本题考查了工业合成氨、催化剂活性、电解原理等知识,题目难度中等,试题综合性强,知识点较多,是一道综合知识的考查题,实际化学反应速率和化学平衡的移动的影响因素、电解食盐水等方面知识.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若保持温度,保持容器容积固定不变,向容器内补充B气体,则有a<b | |
| B. | 若保持温度、压强不变,充入惰性气体,则有a>b | |
| C. | 若其他条件不变,升高温度,则有a<b | |
| D. | 若a=b,则可能是在该温度下,保持容器容积固定不变情况下充入了惰性气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 装置 | 现象 | 结论及解释 |
 | ①A试管中黑色沉淀逐渐溶解 ②A试管上方出现红棕色气体 ③B试管中出现白色沉淀 | a.现象②说明褐色沉淀具有 还原性. b.试管B中产生白色沉淀的总反应的离子方程式为 NO2+SO2+Ba2++H2O═BaSO4↓+NO↑+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光导纤维的主要成分是二氧化硅 | |
| B. | SiO2不与水反应,所以二氧化硅不是酸性氧化物 | |
| C. | 装有烧碱溶液的试剂瓶不能用玻璃塞,是为了防止烧碱与二氧化硅反应生成硅酸钠而使瓶塞与瓶口黏在一起 | |
| D. | 晶体硅是良好的半导体材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
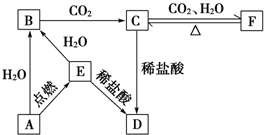
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 生铁易被腐蚀,纯铁不易被腐蚀 | |
| B. | 常温下可用铁制容器来运输浓硫酸 | |
| C. | Fe2+的检验:取少量样品溶液,加入适量氯水,再滴2滴KSCN溶液,振荡观察 | |
| D. | 工业上常用稀盐酸或稀硫酸除铁锈 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com