

| A. | 反应①③均属于置换反应 | |
| B. | 反应①中氧化产物和还原产物的质量比为1:2 | |
| C. | 该流程中反应①③的还原剂不能互换使用 | |
| D. | 该流程是实现半导体工业“从沙滩到用户”的基础 |
分析 A.置换反应是指:一种单质与一种化合物反应生成另一种单质和另一种化合物;
B.依据方程式SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si(粗)+2CO↑判断解答;
C.氢气与硅能反应生成硅烷;
D.沙子主要成分是二氧化硅,经过该流程成为硅.
解答 解:A.反应①SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si(粗)+2CO↑;反应③SiHCl3+H2$\frac{\underline{\;高温\;}}{\;}$Si(纯)+3HCl,二者都是置换反应,故A正确;
B.反应SiO2+2C$\frac{\underline{\;高温\;}}{\;}$Si(粗)+2CO↑,氧化产物为一氧化碳,还原产物为硅,二者物质的量之比为1:2,质量之比为:14:15,故B错误;
C.氢气与硅能反应生成硅烷,所以该流程中反应①③的还原剂不能互换使用,故C正确;
D.沙子主要成分是二氧化硅,经过该流程成为硅,实现半导体工业“从沙滩到用户”的基础,故D正确;
故选:B.
点评 本题考查了工业提纯硅,明确物质的性质及发生反应是解题关键,题目难度不大.


 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案 三新快车金牌周周练系列答案
三新快车金牌周周练系列答案科目:高中化学 来源: 题型:解答题
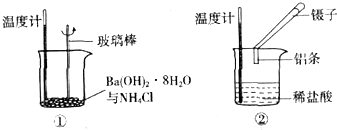
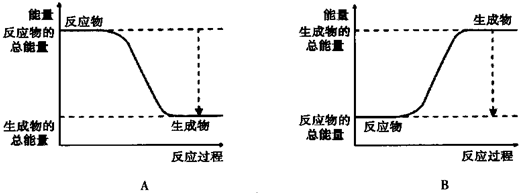
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 若a>c,则滤液中可能含三种金属离子,且b可能小于c | |
| B. | 若a>c,则c g固体中只含一种金属,且b可能大于c | |
| C. | 若a<c,则c g固体含两种金属,且b可能与c相等 | |
| D. | 若a=c,则滤液中可能含两种金属离子,且b可能小于c |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①和②混合后c(H+)=c(CH3COO-)+c(OH-)+2c(SO42-) | |
| B. | ①和④溶液中:c(Na+)=c(CH3COO-)+c(CH3COOH)=0.01mol•L-1 | |
| C. | ②和③混合溶液中:c(SO42-)>c(NH4+)>c(OH-)>c(H+) | |
| D. | 四种溶液各稀释100倍,溶液pH:④>③>①>② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
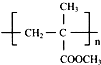 ,以下是有机玻璃的一种合成路线:
,以下是有机玻璃的一种合成路线: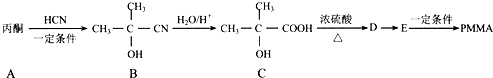
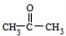 ,A生成B的反应类型是加成反应.
,A生成B的反应类型是加成反应.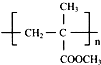 .
. .
. 的同分异构体中符合下列条件的有10种(不考虑立体异构);
的同分异构体中符合下列条件的有10种(不考虑立体异构);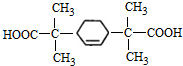 (填结构简式).
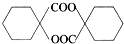
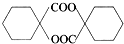
(填结构简式).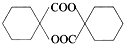 的合成路线:
的合成路线: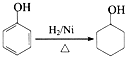 $→_{Cu/△}^{O_{2}}$
$→_{Cu/△}^{O_{2}}$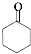 $→_{一定条件}^{HCN}$
$→_{一定条件}^{HCN}$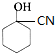 $\stackrel{H_{2}O/H+}{→}$
$\stackrel{H_{2}O/H+}{→}$ $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$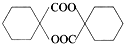 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升温 | B. | 加压 | C. | 减压 | D. | 降温 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
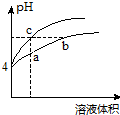 某温度下,体积和pH都相同的氯化铵溶液和盐酸加水稀释时的pH变化曲线如图所示.下列判断正确的是( )
某温度下,体积和pH都相同的氯化铵溶液和盐酸加水稀释时的pH变化曲线如图所示.下列判断正确的是( )| A. | a、c两点溶液的导电能力:c>a | |
| B. | a、b、c三点溶液中水的电离程度:a>b>c | |
| C. | b点溶液中:c(H+)=c(Cl-)+c(OH-) | |
| D. | 用NaOH溶液和等体积b、c处溶液反应,消耗NaOH溶液的体积Vb=Vc |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com