
| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:解答题
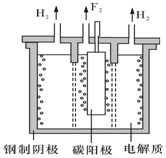 氟是自然界中广泛分布的元素之一.由于氟的特殊化学性质,它和其他卤素在单质及化合物的制备与性质上存在较明显的差异.
氟是自然界中广泛分布的元素之一.由于氟的特殊化学性质,它和其他卤素在单质及化合物的制备与性质上存在较明显的差异.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 电离能 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2080 | 4000 | 6100 | 9400 |
| R | 500 | 4600 | 6900 | 9500 |
| S | 740 | 1500 | 7700 | 10500 |
| T | 580 | 1800 | 2700 | 11600 |
| U | 420 | 3100 | 4400 | 5900 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3H6O2属于酯时有三种同分异构体 | |
| B. | 乙醇、乙酸均能与钠反应放出H2,二者分子中官能团相同 | |
| C. | 向 溶液中通入CO2可得到 溶液中通入CO2可得到 | |
| D. | CH3COOH与CH3CH218OH发生酯化反应可生成CH3CO18OCH2CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上学期第三次调研化学试卷(解析版) 题型:选择题
下列表示对应化学反应的离子方程式正确的是( )
A.用KIO3氧化酸性溶液中的KI:5I-+IO3-+3H2O=3I2+6OH-
B.向NH4HCO3溶液中加过量NaOH溶液并加热:NH4++OH- NH3↑+H2O
NH3↑+H2O
C.将过量SO2通入氨水中:SO2+NH3·H2O=HSO3-+NH4+
D. Ba(OH)2溶液中加入NaHSO4溶液至沉淀完全:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com