
| A. | NH3$\stackrel{O_{2}催化剂}{→}$NO$\stackrel{O_{1}和H_{2}O}{→}$HNO3 | |
| B. | MnO2$→_{△}^{浓盐酸}$Cl2$\stackrel{石灰水}{→}$漂白粉 | |
| C. | 制取Mg:海水$\stackrel{Ca(OH)_{2}}{→}$Mg(OH)2$\stackrel{高温}{→}$MgO$\stackrel{电解}{→}$Mg | |
| D. | 黄铁矿$→_{煅烧}^{沸腾炉}$SO2$→_{O_{2}}^{接触室}$SO3$→_{水}^{吸收塔}$稀H2SO4 |
分析 A.工业制硝酸,利用氨气的催化氧化生成NO,再氧化生成二氧化氮,最后溶于水生成硝酸;
B.工业制氯气为电解饱和食盐水溶液;
C.工业上用电解熔融氯化镁的方法制取镁;
D.工业上用接触法制硫酸,最终用浓硫酸吸收SO3;
解答 解:A.工业制硝酸,利用氨气的催化氧化生成NO,再氧化生成二氧化氮,最后溶于水生成硝酸,与工业生产实际相符合,故A正确;
B.工业制氯气为电解饱和食盐水溶液,不是用二氧化锰与浓盐酸加热生成,与工业生产实际不相符合,故B错误;
C.工业上用电解熔融氯化镁的方法制取镁,不是电解熔融氧化镁的方法制取镁,与工业生产实际不相符合,故C错误;
D.工工业上用接触法制硫酸,最终用浓硫酸吸收SO3,不是用水吸收,与工业生产实际不相符合,故D错误.
故选A.
点评 本题考查化学实验方案评价,为高频考点,涉及工业生产制备物质等知识,把握反应原理及反应与现象的关系为解答的关键,注意从实验的评价性及物质性质分析解答,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 两种气体的压强相等 | B. | O2和O3的原子个数相等 | ||
| C. | 两种气体的氧化能力相同 | D. | 两种气体的分子数目相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高锰酸钾酸性溶液与草酸钾溶液反应:2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O | |
| B. | KI的酸性溶液长期置于空气中::4I-+4H++O2═2I2+2H2O | |
| C. | 硫代硫酸钠溶液中滴加稀硫酸:2H++S2O32-═S↓+SO2↑+H2O | |
| D. | 用食醋除去水垢:CO32-+2CH3COOH═H2O+CO2↑+2CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | A溶液 | B溶液 |
| ① | 20 mL 0.1 mol•L-1H2C2O4溶液 | 30 mL 0.01 mol•L-1kMnO4溶液 |
| ② | 20 mL 0.2 mol•L-1 H2C2O4溶液 | 30 mL 0.01 mol•L-1KMnO4溶液 |
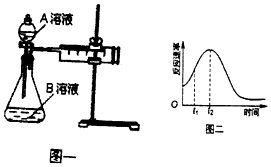
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将5.85 g NaCl固体溶于1 L水中可配成0.1mol/L的NaCl 溶液 | |
| B. | 500 ml 0.5mol/L 的NaOH溶液含NaOH分子0.25 mol | |
| C. | 把200mL 3mol/L的BaCl2溶液跟100mL 3mol/L的KCl溶液混合后,溶液中的c(Cl-)仍然是3mol/L(忽略混合后体积变化) | |
| D. | 把100g 20%的NaCl溶液跟100g H2O混合后,NaCl溶液的质量分数是10% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com