
分析 5min内用C表示的平均反应速率为:v(C)=$\frac{0.5mol/L}{5min}$=0.1mol/(L﹒min),根据反应速率与化学计量数成正比可知,x=2,
设反应开始前容器中A、B的物质的量为n,n(D)=0.5mol•L-1×2L=1mol,
3A(g)+B(g)?2C(g)+2D(g),
开始 n n 0 0
转化 1.5mol 0.5mol 1mol 1mol
5min n-1.5 n-0.5 1 1
则:(n-1.5):(n-0.5)=3:5,
解得:n=3mol,
(1)根据c=$\frac{n}{V}$计算出此时A的浓度;
(2)根据分析可知反应开始前A、B的物质的量;
(3)根据分析可知C的计量数n.
解答 解:5min内用C表示的反应速率为:v(C)=$\frac{0.5mol/L}{5min}$=0.1mol/(L﹒min),根据反应速率与化学计量数成正比可知,x=2,
设反应开始前容器中A、B的物质的量为n,n(D)=0.5mol•L-1×2L=1mol,
3A(g)+B(g)?2C(g)+2D(g),
开始 n n 0 0
转化 1.5mol 0.5mol 1mol 1mol
5min n-1.5 n-0.5 1 1
则:(n-1.5):(n-0.5)=3:5,
解得:n=3mol,
(1)5min后A的浓度为:c(A)=$\frac{3mol-1.5mol}{2L}$=0.75mol/L,
故答案为:0.75;
(2)根据分析可知,反应开始前容器中A、B的物质的量,n(A)=n(B)=3mol,
故答案为:3;
(3)根据分析可知,C的化学计量数n=2,
故答案为:2.
点评 本题考查了化学平衡的计算,题目难度中等,明确化学平衡及其影响因素为解答关键,注意掌握三段式在化学平衡计算中的应用,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:解答题
| 实验次数编号 | 盐酸溶液体积V(mL) | 氢氧化钠溶液体积V(mL) |
| 1 | 19.90 | 10.00 |
| 2 | 20.10 | 10.00 |
| 3 | 22.00 | 10.00 |
| 4 | 20.00 | 10.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
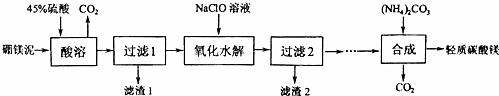
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| NaOH的质量分数 | 阳极析出物质的质量/g | 阴极析出物质的质量/g | |
| A | 6.2% | 19 | 152 |
| B | 6.2% | 152 | 19 |
| C | 4.2% | 1.2 | 9.4 |
| D | 4.2% | 9.4 | 1.2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
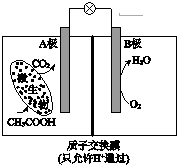
| A. | 外电路电子从B极移向A极 | |
| B. | 溶液中H+由B极区移向A极区 | |
| C. | 电池工作一段时间后B极区溶液的pH减小 | |
| D. | A极电极反应式为:CH3COOH-8e-+2H2O=2CO2+8H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | 键能 | 化学键 | 键能 | 化学键 | 键能 |
| C-F | 427 | C-Cl | 330 | C-I | 218 |
| H-H | 436 | S=S | 255 | H-S | 339 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 光导纤维遇强碱会“断路” | |
| B. | 苹果放在空气中久置变黄和纸张久置变黄原理相似 | |
| C. | “辽宁舰”上用于舰载机降落拦阻索的特种钢缆,属于新型无机非金属材料 | |
| D. | “歼-20”飞机上使用的碳纤维是一种新型的有机高分子材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
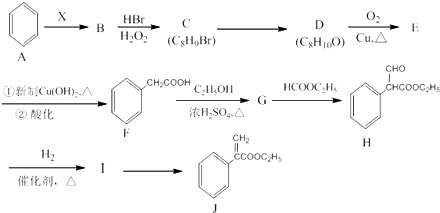
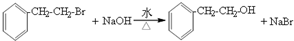 .
.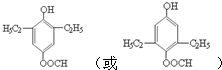 (任写一种即可).
(任写一种即可).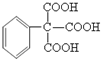 的合成路线流程图(无机试剂任选).
的合成路线流程图(无机试剂任选).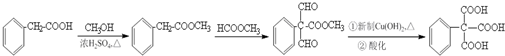 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
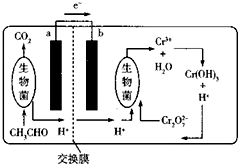 如图所示的微生物燃料电池在净化废水的同时能回收能源或得到有价值的化学产品.下列有关说法不正确的是( )
如图所示的微生物燃料电池在净化废水的同时能回收能源或得到有价值的化学产品.下列有关说法不正确的是( )| A. | b极为正极,发生还原反应 | |
| B. | 负极的电极反应式为CH3CHO-10e-+3H2O═2CO2↑+10H+ | |
| C. | 理论上处理l mol Cr2O72-时有l4mool H+从交换膜左侧向右侧迁移 | |
| D. | 放电时,交换膜右侧生物菌周围溶液的pH增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com