
短周期主族元素A、B、C、D、E的原子序数依次递增,A、B两元素相邻,B、C、E原子的最外层电子数之和为13,E原子最外层电子数是B原子内层电子数的3倍,也是C原子最外层电子数的3倍,B、D原子最外层电子数之和等于C、E原子最外层电子数之和。下列说法正确的是( )
A.原子半径C>D>E ,三者形成的简单离子中D离子的半径最小
B.元素A所形成的氢化物常温下一定为气态
C.元素C、D、E在自然界中均不能以游离态存在
D.元素B的氧化物对应的水化物一定为强酸
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016届海南师大附中高三第九次月考化学试卷(解析版) 题型:填空题
短周期元素 W、X、Y、Z 在元素周期表中的位置如右图所示。其中 Z 的单质是一种重要半导体材料,广泛应用于电子工业的各个领域。
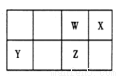
(1)W 在元素周期表中的位置是____________。
(2)W、X、氢元素形成的三原子分子的电子式____________。
(3)下列选项中,能证明元素非金属性X强于W的是____________。
A.相对原子质量:X>W B.最低化合价:X>W
C.最简单氢化物的稳定性:X>W D.最高价氧化物的水化物酸性:X>W
(4)元素周期表中与 Z 同周期的某金属元素形成的单质 A,可发生如下图所示的转化:
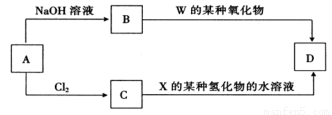
其中化合物D是一种白色沉淀,则 B 中溶质的化学式为____________;
B与 C也可直接转化生成 D 写出对应的离子方程式为____________。
查看答案和解析>>
科目:高中化学 来源:2016届海南中学高三高考模拟八化学试卷(解析版) 题型:实验题
醇酸树脂是一种成膜性好的树脂,下面是二种醇酸树脂的合成线路:

已知:RCH2CH=CH2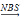
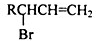
(1)B中含有的官能团的名称是___________________;
(2)反应①、③的有机反应类型分别是______________、_____________;
(3)若鉴别物质E,可选用的试剂为_________(填以下试剂的序号字母)
A.NaHCO3 B.银氨溶液 C.新 Cu(OH)2悬浊液 D.FeCl3溶液
(4)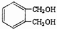 的同分异构体中同时符合下列条件的芳香族化合物,试写出其中一种的结构简式______;
的同分异构体中同时符合下列条件的芳香族化合物,试写出其中一种的结构简式______;
A.能发生消去反应 B.能与过量浓溴水反应生成白色沉淀 C.苯环上有两个互为对位的取代基
(5)写出E生成F的化学方程式___________________;
(6)写出反应⑤的化学方程式___________________。
查看答案和解析>>
科目:高中化学 来源:2016届海南中学高三高考模拟八化学试卷(解析版) 题型:选择题
下列实验过程中,始终无明显现象的是
A.CO2通入到CaCl2溶液中
B.NH3通入AlCl3溶液中
C.用脱脂棉包裹Na2O2粉末向其中通入适量二氧化碳
D.稀盐酸滴加到Fe(OH)3胶体中
查看答案和解析>>
科目:高中化学 来源:2016届青海省西宁市等校高三下联考理综化学试卷(解析版) 题型:填空题
燃煤能排放大量的CO、CO2、SO2,PM2.5(可入肺颗粒物)污染也跟冬季燃煤密切相关。SO2、CO、CO2也是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径。
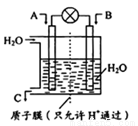
(1)如图所示,利用电化学原理将SO2 转化为重要化工原料C,若A为SO2,B为O2,则负极的电极反应式为:___________;
(2)有一种用CO2生产甲醇燃料的方法:CO2+3H2 CH3OH+H2O
CH3OH+H2O
已知:CO2(g)+3H2(g) CH3OH(g)+H2O(g)△H=-a kJ·mol-1;
CH3OH(g)+H2O(g)△H=-a kJ·mol-1;
2H2(g)+O2(g)=2H2O(g)△H=-b kJ·mol-1;
H2O(g)=H2O(l)△H=-c kJ·mol-1;
CH3OH(g)=CH3OH(l)△H=-d kJ·mol-1。
则表示CH3OH(l)燃烧热的热化学方程式为:____________________________;
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
实验组om] | 温度℃ | 起始量/mol[ | 平衡量/mol | 达到平衡所需 时间/min | ||
CO | H2O | H2 | CO | |||
1 | 650 | 4 | 2 | 1.6 | 2.4 | 6 |
2 | 900 | 2 | 1 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验2条件下平衡常数K=________,该反应的ΔH________0 (填“>”或“<”)。
②实验3中,若平衡时,CO的转化率大于水蒸气,则b/a 的值______(填具体值或取值范围)。
③实验4,若900℃时,在此容器中加入CO、H2O、CO2 、H2均为1mol,则此时V逆 V正(填“<” ,“>” ,“=”)。
④判断该反应达到平衡的依据是________。
A.CO2减少的化学反应速率和CO减少的化学反应速率相等 B.容器内气体压强保持不变
C.CO、H2O、CO2、H2的浓度都相等 D.容器中气体的平均相对分子质量不随时间而变化
查看答案和解析>>
科目:高中化学 来源:2016届江西省高三5月月考理综化学试卷(解析版) 题型:实验题
钼酸钠晶体( Na2MoO4·2H2O)是一种无公害型冷却水系统的金属缓蚀剂。工业上利用钼精矿(主要成分是不溶于水的MoS2)制备钼酸钠的两种途径如图所示:
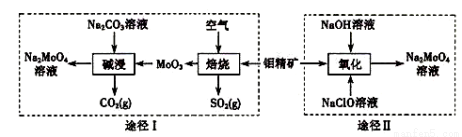
(1) NaClO的电子式是 。
(2)为了提高焙烧效率,除增大空气量外还可以采用的措施是 。
(3)途径I碱浸时发生反应的化学反应方程式为 。
(4)途径Ⅱ氧化时发生反应的离子方程式为 。
(5)分析纯的钼酸钠常用四钼酸铵[(NH4)2MoO4]和氢氧化钠反应来制取,若将该反应产生的气体与途径I所产生的尾气一起通入水中,得到正盐的化学式是 。
(6)钼酸钠和月桂酰肌氨酸的混合液常作为碳素钢的缓蚀剂。常温下,碳素钢在三种不同介质中的腐蚀速率实验结果如下图:
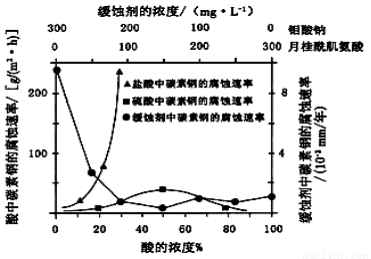
①要使碳素钢的缓蚀效果最优,钼酸钠和月桂酰肌氨酸的浓度比应为__ __。
②当硫酸的浓度大于90%时,腐蚀速率几乎为零,原因是 。
③试分析随着盐酸和硫酸浓度的增大,碳素钢在两者中腐蚀速率产生明显差异的主要原因是 。
查看答案和解析>>
科目:高中化学 来源:2016届江西省高三5月月考理综化学试卷(解析版) 题型:选择题
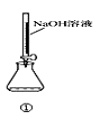
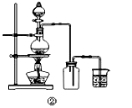
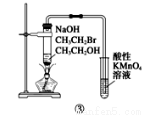
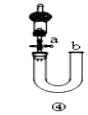
对下图的实验装置和操作评价不合理的是( )
选项 | 装置和操作 | 评价 |
A | 用装置①量取15.00ml的NaOH溶液 | 错误:不能用酸式滴定管,应改用碱式滴定管 |
B | 用装置②制备Cl2 | 错误:氯气密度大于空气,收集时导管应长进短出 |
C | 用装置③验证溴乙烷发生消去反应生成烯烃 | 正确:生成的乙烯可使高锰酸钾褪色 |
D | 关闭活塞a,从b处加水,以检查装置④的气密性 | 正确:b处加水后,左右液面形成稳定的高度差,证明气密性良好 |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江双鸭山一中高二下期中化学试卷(解析版) 题型:推断题
液晶高分子材料应用广泛.新型液晶基元﹣化合物Ⅳ的合成线路如下:
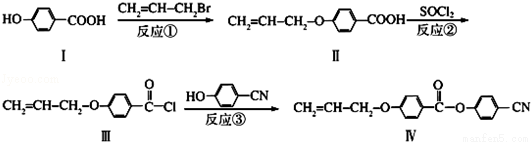
(1)化合物Ⅰ的分子式为 ,含有的官能团 ,1mol化合物Ⅰ完全燃烧消耗标准状况下 O2 L。
(2)CH2=CH﹣CH2Br与NaOH水溶液反应的化学方程式为 (注明条件)。
(3)下列关于化合物Ⅱ的说法正确的是 (填字母)。
A.能与FeCl3溶液反应呈紫色 B.属于烯烃
C.最多能与4mol H2发生加成反应 D.一定条件下能发生加聚反应
(4)反应③的反应类型是 。在一定条件下,化合物 也可与Ⅲ发生类似反应③的反应生成有机物Ⅴ,Ⅴ的结构简式是 。
也可与Ⅲ发生类似反应③的反应生成有机物Ⅴ,Ⅴ的结构简式是 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江牡丹江一中高一下期中化学试卷(解析版) 题型:选择题
按下图装置进行实验,若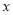 轴表示流入正极的电子的物质的量,则y轴可以表示( )
轴表示流入正极的电子的物质的量,则y轴可以表示( )
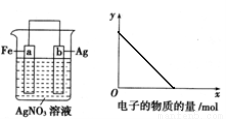
①c(Ag+) ②c(NO3-)③a棒的质量 ④b棒的质量 ⑤溶液的质量
A.①③ B.②④ C.①③⑤ D.②④⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com