
【题目】某小组为研究电化学原理,设计如图装置。下列叙述不正确的是( )

A.a和b不连接时,铁片上会有金属铜析出
B.a和b用导线连接时,铜片上发生的反应为:Cu2++2e-= Cu
C.无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
D.a和b用导线连接时,SO42-向铜电极移动
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】25 ℃时,向Na2CO3溶液中滴入盐酸,混合溶液的pH与离子浓度变化的关系如图所示。
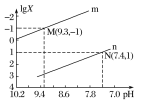
已知:lg X=lg c(CO32-)/c(HCO3-)或lg c(HCO3-)/c(H2CO3),下列叙述正确的是( )
A. 曲线m表示pH与c(HCO3-)/c(H2CO3)的变化关系
B. 当溶液呈中性时,c(Na+)=c(HCO3-)+2c(CO32-)
C. Ka1(H2CO3)=1.0×10-6.4
D. 25 ℃时,CO32-+H2O![]() HCO3-+OH-的平衡常数为1.0×10-7.6
HCO3-+OH-的平衡常数为1.0×10-7.6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C是中学化学常见的三种物质,它们之间的相互转化关系如图(部分反应条件及产物略去)。
![]()
(1)若A是一种黄色单质固体,则B→C的化学方程式为____。
(2)若A是一种活泼金属,C是淡黄色固体,则C的名称为____,试用化学方程式表示该物质与水的反应____。将C长期露置于空气中,最后将变成物质D,D的化学式为____。
(3)若C是红棕色气体,A是一种能使湿润的红色石蕊试纸变蓝的气体。请结合所学知识,写出实验室制取A的化学方程式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计了一组实验来探究第ⅦA族元素原子的得电子能力强弱规律。下图中A、B、C是三个可供选择制取氯气的装置,装置D的玻璃管中①②③④处依次放置蘸有NaBr溶液、淀粉碘化钾溶液、NaOH浓溶液和品红溶液的棉球。
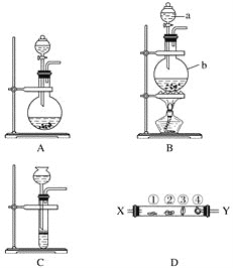
(1)写出装置B中指定仪器的名称a________,b_________。
(2)实验室制取氯气还可采用如下原理:2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O。依据该原理需要选择A、B、C装置中的________装置制取氯气。
(3)反应装置的导气管连接装置D的________(填“X”或“Y”)导管,试回答下列问题
①处所发生反应的离子方程式:____________________;
②处的现象:____________________;
③处所发生反应的离子方程式:__________________________。
(4)装置D中④的作用是__________________。
(5)某同学根据①②两处棉球颜色的变化得出结论:Cl、Br、I原子的得电子能力依次减弱。上述实验现象________(填“能”或“不能”)证明该结论、理由是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,装置在常温下工作(溶液体积变化忽略不计).闭合K,灯泡发光.下列叙述中不正确的是( )
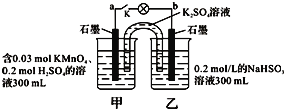
A.当电路中有1.204×1022个电子转移时,乙烧杯中溶液的H+浓度约为0.1mol/L
B.电池工作时,盐桥中的K+移向甲烧杯,外电路的电子方向是从b到a
C.电池工作时,甲烧杯发生的反应为MnO4- + 3e- + 4H+ = MnO2 + 2H2O
D.乙池中的氧化产物为SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(9分)
新型高效的甲烷燃料电池采用铂为电极材料,两电极上分别通入CH4和O2 ,电解质为KOH溶液。某研究小组将两个甲烷燃料电池串联后作为电源,进行饱和氯化钠溶液电解实验,如图所示。

回答下列问题:
(1)甲烷燃料电池正极、负极的电极反应分别为 、 。
(2)闭合K开关后,a、b电极上均有气体产生.其中b电极上得到的是 ,电解氯化钠溶液的总反应方程式为 ;
(3)若每个电池甲烷通入量为1 L(标准状况),且反应完全,则理论上通过电解池的电量为
(法拉第常数F=9.65×l04C.mol-1,列式计算),最多能产生的氯气体积为 L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,0.1 mol·L-1的某二元酸H2A溶液中,可能存在的含A粒子(H2A、HA-、A2-)的物质的量分数随pH变化的关系如图所示,下列说法正确的是( )
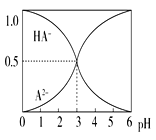
A. H2A的电离方程式:H2A![]() H++HA-
H++HA-
B. pH=5时,在NaHA和Na2A的混合溶液中:c(HA-):c(A2-)=1:100
C. 等物质的量浓度的NaHA和Na2A溶液等体积混合, 离子浓度大小关系为:c(Na+)>c(HA-)>c(A2-)
D. Na2A溶液必存在c(OH-)=c(H+)+c(HA-)+ 2c(H2A),各粒子浓度均大于0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着人们的物质生活水平的不断提高和工业化快速发展,环境污染也日益加重,空气中有毒气体主要包括SO2、CO、NOx、烃类等等。
(1)在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2和水。已知CH4和S的燃烧热ΔH分别为-890 kJ/mol和-297kJ/mol,则CH4和SO2反应的热化学方程式为_________________________________________。
(2)在20 L的密闭容器中按物质的量之比1∶2充入CO和H2,发生反应:CO(g)+2H2(g)![]() CH3OH(g) ΔH。测得CO的转化率随温度及不同压强的变化如图所示,P2和195 ℃时n(H2)随时间的变化结果如表所示。
CH3OH(g) ΔH。测得CO的转化率随温度及不同压强的变化如图所示,P2和195 ℃时n(H2)随时间的变化结果如表所示。


①P2及195℃下,在B点时,v(正)_____v(逆)(填“>”、“<”或“=”)。
②该反应的ΔH_________0(填“>”、“<”或“=”),原因是______________________________。
③在0~2 min,平均反应速率v(CH3OH)=______________________。(数值用小数形式表示)
④在P2及195 ℃时,该反应的平衡常数Kp=__________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数,结果用含P2的分式表示)。
(3)某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理见图所示。

①气体A中除了O2外,一定还含有的气体是________。
②该电池的负极反应式为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A—F是几种典型有机代表物的分子模型,请看图回答下列问题。

(1)常温下含碳量最高的是________(填对应字母);
(2)一卤代物种类最多的是 ___________(填对应字母);
(3)A、B、D三种物质的关系为____________________________________
(4)F中一定在同一个平面的原子数目为_____________________
(5)写出C使溴水褪色的方程式 ___________
(6)写出E发生溴代反应的化学方程式______________________________;
(7)写出C的官能团的名称______________________
(8)F的二溴取代产物有_____________种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com